Diferencia entre revisiones de «Gripe»
m Revertidos los cambios de 190.253.166.219 (disc.) a la última edición de AVBOT |
|||
| Línea 64: | Línea 64: | ||
|- |
|- |
||
! [http://es.wikipedia.org/wiki/Gripe#Pandemia_de_neogripe_A_.28H1N1.29_de_2009-2010 Neogripe A] |
! [http://es.wikipedia.org/wiki/Gripe#Pandemia_de_neogripe_A_.28H1N1.29_de_2009-2010 Neogripe A] |
||
|2009–2010 ||82 ||[[H1N1]] || |
|2009–2010 ||82 ||[[H1N1]] ||5 |
||
|} |
|} |
||
Revisión del 20:00 11 jun 2009
| Gripe | ||
|---|---|---|
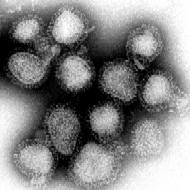
 Partícula viral o "virión" del virus de la gripe | ||
| Especialidad |
medicina familiar neumología infectología medicina de emergencia | |
| eMedicine | med/1170 | |
La gripe, gripa o influenza es una enfermedad infecciosa de aves y mamíferos causada por un tipo de virus de ARN de la familia de los Orthomyxoviridae. Las palabras gripe y gripa proceden de la francesa grippe (procedente del suizo-alemán grüpi (acurrucarse), mientras que influenza procede del italiano.
En los seres humanos afecta a las vías respiratorias; inicialmente puede ser similar a un resfriado y con frecuencia se acompaña de síntomas generales como fiebre, dolor de garganta, debilidad, dolores musculares, dolor estomacal (mialgias), articulares (artralgias), y de cabeza (cefalea), con tos (que generalmente es seca y sin mucosidad) y malestar general.[1] En algunos casos más graves puede complicarse con pulmonía (neumonía), que puede resultar mortal, especialmente en niños pequeños y sobre todo en ancianos. Aunque se puede confundir con el resfriado (catarro) común, la gripe es una enfermedad más grave y está causada por un tipo diferente de virus.[2] También puede provocar, más a menudo en niños, náuseas y vómitos,[1] que al ser síntomas de gastroenteritis hace que se denomine gripe estomacal o abdominal.[3]
La gripe se transmite desde individuos infectados a través de gotas en aerosol cargadas de virus (procedentes de saliva, secreción nasal y bronquial), que son emitidas con la tos o los estornudos o sólo al hablar. Ya mucho más raramente, a través de las heces de pájaros infectados. También es transmisible por la sangre[1] y por las superficies u objetos contaminados con el virus, que se denominan fomites.
Los virus de la gripe resisten más en ambiente seco y frío. Pueden conservar su capacidad infectiva durante una semana a la temperatura del cuerpo humano, durante 30 días a 0 °C y durante mucho más tiempo a menores temperaturas.[4][5] Puede ser fácilmente inactivado mediante detergentes o desinfectantes.[6][7][8]
La gripe se distribuye en epidemias estacionales que provocan cientos de miles de defunciones, que pasan a ser millones en los años de pandemia (epidemia global). Durante el siglo XX se produjeron cinco pandemias de gripe debido a la aparición por mutación de diferentes cepas del virus. A menudo estas nuevas cepas han surgido a partir del trasvase de cepas típicas de animales al ser humano, en lo que se denomina salto de especie o heterocontagio. Una variante mortal del virus de la gripe aviar denominada H5N1 pasó por ser la principal candidata para la siguiente pandemia de gripe en humanos desde que traspasó la barrera de especie en los años 1990 y provocó decenas de defunciones en Asia, hasta la aparición de la neogripe A (H1N1) en 2009. Afortunadamente aquella variante aviar no mutó y no puede transmitirse de persona a persona, pues sólo afectó a humanos desde aves contagiadas y ese contagio no es fácil pues requiere unas condiciones muy especiales.[9]
En los países desarrollados se han establecido campañas de vacunación anual frente a la gripe para las personas con mayor riesgo de contraer la enfermedad o que son más vulnerables a sus complicaciones,[10] así como controles estrictos a las aves de corral.[11] La vacuna humana habitual es la trivalente, que contiene proteínas purificadas e inactivadas de las tres cepas se consideran van a ser más comunes en la siguiente epidemia: dos subtipos del virus A de la gripe y uno del virus B.[12] Una vacuna elaborada un año puede no ser eficaz al siguiente debido a las frecuentes y rápidas mutaciones (cambios en sus antígenos) que sufre el virus, y a la dominancia variable de las diferentes cepas.
El tratamiento es sólo sintomático y en los casos graves y hospitalarios es sólo de mantenimiento de constantes, pues los fármacos antivirales tienen una eficacia muy limitada (los más eficaces son los inhibidores de la neuraminidasa) y no carecen de toxicidad. Los antibióticos sólo son útiles si hay infección bacteriana asociada.
El pronóstico es bueno con recuperación parcial a la semana y total a los quince días, siendo, en las epidemias habituales, los exitus letalis consecuencia de la patología o del deficiente estado inmunitario, previos a la infección gripal.
En España la gripe es de declaración obligatoria, no nominal y no urgente. Todos los viernes ha de remitirse a las autoridades sanitarias el número de casos nuevos atendidos durante la semana. Antes de 2009 nunca se requiería encuesta epidemiológica, dada su alta morbilidad (cantidad porcentual de afectados) pero está sí debe realizarse actualmente en los casos de neogripe A, incluso antes de la confirmación por el laboratorio.
Historia
Los síntomas de la gripe en humanos fueron descritos por Hipócrates hace unos 2.400 años.[13][14] Desde entonces el virus ha causado, además de la epidemia anual, numerosas pandemias. Los datos históricos sobre la gripe son difíciles de interpretar porque los síntomas pueden ser similares a los de otras enfermedades, como la difteria, la neumonía, el dengue o el tifus. Desde 1510 se han descrito unas 31 pandemias. El primer registro detallado de una pandemia gripal se produjo en 1850. Comenzó en Asia y se extendió a Europa y a África. Las pandemias se sucedieron durante los siglos XVII y XVIII, siendo la de 1830–1833 especialmente virulenta y de gran morbilidad, ya que infectó aproximadamente una cuarta parte de la población expuesta.[15]
La pandemia más letal y conocida fue la denominada gripe española (virus A, subtipo H1N1), que duró desde 1918 a 1919. Se denomina así porque España era el país que publicaba más datos sobre el desastre sanitario que estaba ocasionando pues muchos los censuraban con motivo de la primera guerra mundial en la cual estaban inmersos. Las estimaciones más antiguas hablaban de unos 40 ó 50 millones de muertos causados por ella,[16] aunque las aproximaciones más actuales sitúan la cifra entre 50 y 100 millones de personas fallecidas por aquella gripe en todo el mundo.[17] Esta pandemia ha sido descrita como el mayor holocausto médico de la historia, y causó al menos tantos muertos como la peste negra.[15] Esta gran mortalidad fue debida a la gran tasa de infectividad (hasta el 50% de la población expuesta) y a la gravedad de los síntomas causados por la producción masiva de citoquinas (tormenta de citoquinas).[16] A esto hay que sumar que los primeros síntomas, en 1918, fueron atribuidos a otras enfermedades como dengue, cólera, o la fiebre tifoidea. Un observador escribía que "una de las peores complicaciones es la hemorragia de las mucosas, especialmente la nasal, la del estómago o la intestinal. También son frecuentes el sangrado de oídos y las petequias".[17] La mayor parte de las muertes ocurrieron por neumonía bacteriana, una infección secundaria provocada por la gripe, pero el virus también mató, directamente, a consecuencia de las hemorragias masivas y el edema pulmonar.[18]
La pandemia de la gripe española tuvo un origen geográfico aún dudoso y se extendió por todo el planeta incluso al Ártico y a remotas islas del Océano Pacífico. La gravedad inesperada de la enfermedad produjo la muerte de entre el 2 y el 20% de todos los infectados, (frente a la tasa habitual de mortalidad de la gripe común, que está en torno al 0.1%).[17][18] Otra característica diferencial de esta pandemia fue que la mortalidad afectó sobre todo a adultos jóvenes, con un 99% de las muertes en personas por debajo de los 65 años, y más de la mitad en adultos entre los 20 y los 40 años.[19] La gripe común tiene sus mayores tasas de mortalidad, por el contrario, en los estratos de población más joven (menores de dos años) y sobre todo entre los mayores de 70. La mortalidad total real de la pandemia de gripe de 1918–1919 no se conoce con certeza pero se estima que en torno al 2.5% al 5% de la población mundial murió por su causa (unos 25 millones de personas sólo en las primeras 25 semanas). Fue la pandemía más mortífera de la historia de la humanidad, superando a la de la peste negra. Valga como comparación que el virus del SIDA ha causado esa misma cantidad de muertes en sus primeros 25 años de existencia.[17]
Las pandemias posteriores de gripe (la gripe asiática (tipo A, subtipo H2N2) y la de 1968 o gripe de Hong Kong (tipo A, subtipo H3N2) no han sido tan devastadoras pero también provocaron millones de defunciones. En las últimas pandemias, la disponibilidad de antibióticos ha servido para controlar las infecciones oportunistas y esto ayudó a reducir la tasa de mortalidad con respecto a la de la gripe española del 18.[18]
| Nombre de la pandemia | Fecha | Muertes | Subtipo involucrado | Índice de gravedad de la Pandemia |
|---|---|---|---|---|
| Gripe rusa | 1889–1890 | 1 millón | posiblemente H2N2 | ? |
| Gripe española | 1918–1920 | 40 a 100 millones | H1N1 | 5 |
| Gripe asiática | 1957–1958 | 1 a 1.5 millones | H2N2 | 2 |
| Gripe de Hong Kong | 1968–1969 | 0.75 a 1 millones | H3N2 | 2 |
| SARS | 2003-2004 | 774 | ||
| Neogripe A | 2009–2010 | 82 | H1N1 | 5 |
La familia de virus Orthomyxoviridae es la causante (etiología) de la gripe, y fue descrita por primera vez en cerdos por Richard Schope en 1931.[21] Este descubrimiento fue seguido en breve por el aislamiento del virus en humanos por un grupo de investigación dirigido por Patrick Laidlaw y el Medical Research Council del Reino Unido en 1933.[22] Sin embargo, hubo que esperar hasta 1935 para que Wendell Stanley estableciera la verdadera naturaleza no celular de los virus.
El primer paso significativo hacia la prevención de la gripe fue el desarrollo de una vacuna de virus muertos por Thomas Francis, Jr en 1944. Posteriormente Frank Macfarlane Burnet demostró que los virus pierden virulencia al ser cultivados en proteína de huevo, posibilitándose así las vacunas de virus inactivados, mucho más eficaces.
La aplicación de esta observación permitió a un grupo de investigadores de la Universidad de Míchigan desarrollar la primera vacuna empleada en población, [23] con la colaboración del ejército de los Estados Unidos.[24] La decisión del ejército de participar en el desarrollo de esta vacuna se debió a su experiencia con la gripe durante la Primera Guerra Mundial, cuando miles de soldados murieron por el virus en cuestión de pocos meses.[17]
Aunque se desataron algunos temores con la gripe del cerdo de New Jersey en 1976, en 1977 con un rebrote de la gripe rusa y en Hong Kong y otros países asiáticos en 1997 (con la variante H5N1 de la gripe aviar), no ha habido ninguna pandemia de importancia desde la gripe de Hong Kong de 1968. La inmunidad adquirida con las pandemias previas y las campañas de vacunación parecen haber limitado la extensión del virus y pueden ayudar a prevenir futuras pandemias.[20]
Etiología: virología
Tipos de virus de la gripe
El virus de la gripe es un virus ARN de la familia de los Orthomyxoviridae, que comprende cinco géneros:[25]
Sólo los tres primeros (influenzavirus) son causantes de gripe. La nomenclatura general de los virus de la gripe como tipos A, B o C se basa en características antigénicas de la nucleoproteína (NP) y los antígenos proteínicos de la matriz (M) para cada género. Cada género a su vez, se subtipifica y las cepas o subtipos se designan siguiendo este criterio:[26]
- Tipo del virus gripal
- Lugar de origen
- Número de cepa
- Año de aislamiento
- Subtipo según estructura H/N
Por ejemplo: «A/Hong Kong/5/68 (H3N2)»
Influenzavirus A
Este género posee una especie, el Influenza A virus.[27] Las aves acuáticas salvajes son los huéspedes naturales de sus muchos subtipos. En ocasiones los virus pueden transmitirse a otras especies lo que puede provocar graves epidemias en la población de aves para consumo humano, o saltar directamente al hombre con la consiguiente pandemia.[28] Los virus de tipo A son los patógenos más agresivos de los tres géneros que pueden provocar la enfermedad. En función del anticuerpo dominante pueden ser divididos en varios serotipos diferentes.[29] Los serotipos que han sido confirmados en humanos, ordenados por el número conocido de muertes en pandemia son:
- H1N1, causante de la gripe española en 1918
- H2N2, responsable de la gripe asiática en 1957
- H3N2, que causó la gripe de Hong Kong en 1968
- H5N1, responsable de la amenaza de pandemia en 2007–08.
- H7N7, que tiene un inusual potencial zoonótico[30]
- H1N2, endémico en humanos y cerdos.
- H9N2
- H7N2
- H7N3
- H10N7
Influenzavirus B
Este género comprende a la especie Influenza B virus.[27] Infecta casi en exclusiva a humanos[29] y es menos frecuente y menos agresivo que el tipo A. Además del hombre, el único animal susceptible de ser infectado por este tipo de virus es la foca.[31] Este virus tiene una tasa de mutación de 2 a 3 veces más baja que el tipo A[32] por lo que es genéticamente menos diverso, conociéndose solamente un serotipo del grupo B.[29] A consecuencia de esta carencia de variabilidad antigénica un cierto grado de inmunidad frente a este tipo se adquiere normalmente desde la infancia. Sin embargo, presenta el suficiente grado de mutación como para impedir la inmunidad completa y definitiva.[33] Esta reducida tasa de cambios antigénicos, en combinación con su limitado rango de huéspedes posibles determina la inexistencia de pandemias de virus tipo B.[34]
Influenzavirus C
Este género posee una especie: el Influenza C virus,[27] que infecta a humanos y a cerdos, y que puede causar cuadros graves y epidemias locales en animales.[35] El tipo C es menos frecuente que los otros dos tipos, y parece ser responsable con cierta frecuencia de cuadros banales en niños.[36][37]
Estructura y propiedades

Los Influenzavirus A, B y C poseen una estructura muy parecida.[38] Las partículas víricas alcanzan un diámetro de entre 80 y 120 nanómetros con una forma más o menos esférica, aunque en ocasiones pueden verse algunos ejemplares de tipo filamentoso.[39] Aunque inusual para un virus su genoma no es un fragmento único de ácido nucleico sino que contiene siete u ocho fragmentos de ARN inverso. El genoma del tipo A codifica 11 proteínas: Hemaglutinina (HA), Neuraminidasa (NA), Nucleoproteína (NP), M1, M2, NS1, NS2(NEP), PA, PB1, PB1-F2 y PB2.[40]
HA y NA son grandes cadenas glicoproteicas que se proyectan del exterior de la partícula vírica. HA es una lectina mediadora de la fijación del virus a la célula diana y de la entrada del material genético en ella, mientras que NA está involucrada en la liberación de la progenie viral desde las células infectadas al exterior, mediante la ruptura de azúcares que ligan a las partículas virales maduras.[41] Estas proteínas son objetivos para los fármacos antivirales.[42] Además cumplen una función de antígeno al que los anticuerpos pueden fijarse. Los influenzavirus A están clasificados en subtipos basándose en la respuesta antigénica a HA y NA, dando lugar a la nomenclatura H y N como se mencionó más arriba.[20]
Patogenia
Infección

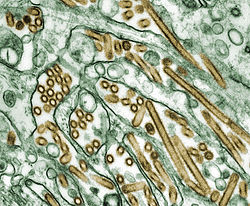
Los virus de la gripe se fijan mediante hemaglutininas a los azúcares de ácido siálico de la membrana celular de las células epiteliales mucosas de las fosas nasales, garganta y pulmones (más en nasofaringe y tráquea pues la afectación bronquiolar y alveolar se da sólo en los casos graves), en los mamíferos, y del intestino, en las aves. (Paso 1 de la imagen).[43]
Replicación
La célula importa el virus mediante endocitosis. Los ciclos de replicación duran entre 4 y 6 horas. En el endosoma así formado, parte de las proteínas de hemaglutinina fusionan la cubierta viral con la membrana vacuolar, liberando las moléculas de ARN vírico, proteínas accesorias y de ARN polimerasa al citoplasma (Paso 2).[44] Estas proteínas y el ARN forman un complejo que es transportado al núcleo celular, donde la ARN polimerasa comienza a transcribir copias complementarias positivas del ARN inverso (antisentido). (Pasos 3a y b).[45] El ARN vírico puede ser devuelto al citoplasma y transcrito (Paso 4), o permanecer en el núcleo. Las proteínas víricas recién creadas son también secretadas mediante el aparato de Golgi hacia la superficie celular (en el caso de la neuraminidasa y la hemaglutinina, Paso 5b) o transportadas de vuelta al núcleo para fijarse al ARNv y formar nuevas partículas víricas (Paso 5a). Otras proteínas víricas tienen múltiples acciones en la célula huésped, incluyendo la propia degradación del ARN celular con el fin de emplear los nucleótidos resultantes para la síntesis de más ARNv e inhibiendo la transcripción del ARN celular.[46] El genoma vírico está compuesto por ochos segmentos de ARN de una sola cadena (monocatenario).[26]
El ARN inverso formado dará lugar al genoma de futuros virus, ARN polimerasa y otras proteínas virales que se ensamblarán en un nuevo virión con capacidad infectante. Las moléculas de hemaglutinina y neuraminidasa se agrupan formando protuberancias en la membrana celular. El ARN vírico y las proteínas de la nucelocápsida salen del núcleo y entran en estas protuberancias de la membrana (Paso 6). Los virus maduros se abren al exterior de la célula en una esfera de fosfolípidos de membrana, adquiriendo hemaglutinina y neuraminidasa junto con esta cubierta membranosa. (Paso 7).[47] De nuevo, las partículas víricas así formadas se adherirán a nuevas células huésped mediante las hemaglutininas transportadas; los virus maduros se liberan entonces una vez que las neuraminidasas rompen los residuos de ácido siálico de la célula huésped.[43] Tras la liberación de la nueva generación de partículas víricas, la célula huésped muere.
Existe una animación sobre la replicación del virus dentro de las celulas en el Observatorio para la Salud [5]
Mutaciones antigénicas
Aproximadamente una vez cada diez mil nucleótidos (la longitud del ARN del virus), la ARN polimerasa comete un error en la inserción de un nucleótido (debido a la ausencia de enzimas de prueba de lectura de ARN) lo que ocasiona que casi cada nuevo virus creado porta al menos una mutación.[48] Esas mutaciones provocan la variación antigénica de los virus y las dificultades del sistema inmunológico para identificarlos como tales y eliminarlos.
La separación del genoma en ocho fragmentos diferentes permite recombinar los cambios si más de una estirpe viral infecta a la misma célula. El recambio rápido resultante en el material genético produce cambios antigénicos y permite al virus infectar nuevas especies huésped y superar rápidamente los mecanismos de defensa inmunitaria.[20] Esto tiene trascendencia en la fase de emergencia de las pandemias como se discutirá en la sección de epidemiología.
Daño periférico
La viremia es excepcional y el virus habitualmente sólo es localizable en las vías respiratorias, pero en casos graves en la autopsia se han encontrado virus en hígado, bazo, corazón, riñones y ganglios linfáticos. Los síntomas, distales al aparato respiratorio y habituales de la gripe (como la fiebre, la cefalea o la astenia) tienen su origen en las enormes cantidades de citoquinas y quemoquinas (como el interferón o el factor de necrosis tumoral) producidas y liberadas por las células infectadas por el virus.[2][49] Pero en contraste con el rhinovirus, causante del catarro común, la gripe causa un cierto grado de daño tisular, por lo que los síntomas no son exclusivamente debidos a la respuesta inflamatoria.[50]
Respuesta inmune
En la defensa inmune contra el virus se implican 5 mecanismos:
- Inmunidad celular específica, muy temprana, con multiplicación de las linfocitos T citotóxicos.
- respuesta inflamatoria inespecífica.
- Producción de interferón.
- Inmunidad humoral con aparición de anticuerpos circulantes con un máximo hacia la segunda semana que se detectan mediante IHA (inhibición de la hemoaglutinación, neutralización, fijación del complemento, ELISA (inmunoabsorción por enzimas) etc.
- Inmunidad humoral con aparición de anticuerpos locales (IgA).
La eliminación del virus (hacia el 8º día) seguramente es debida a los 3 primeros mecanismos pues los 2 últimos, con producción de anticuerpos, son tardíos.
Anatomía patológica
Las células de la mucosa que forma el epitelio respiratorio presentan cambios inflamatorios (tumefacción) del núcleo y en el espacio intracelular (citoplasma) se forman vacuolas ("burbujas") fruto de dichos cambios. Finalmente la célula se necrosa (muere) y se desprende dejando la capa basal del epitelio expuesta: esta capa es mucho más sensible, es incapaz de retener el moco y su exposición es la causa de la mayor parte de los síntomas respiratorios del cuadro.
Cinco días después se inicia la regeneración que inicialmente tiene aspecto metaplásico (células atípicas) pero que a las dos semanas adquiere un aspecto totalmente normal.
Si se produce una neumonía vírica se puede producir la pérdida de epitelio ciliado en la tráquea, bronquios y bronquiolos. Los alveolos pulmonares se ven con las paredes engrosadas por edema (líquido en su interior) e infiltración y con un revestimiento membranoso hialino (de tejido conectivo en respuesta a la inflamación). Con ello el intercambio de oxígeno entre el pulmón y la sangre se ve comprometido y el déficit de oxigeno en sangre puede ocasionar una disminución global de oxígeno disponible para los tejidos (hipoxia tisular), con el consiguiente deterioro funcional.
Epidemiología
Variaciones estacionales
La incidencia global se calcula en 10-20% pero la selectiva, en determinados grupos poblacionales, puede llegar al 40-50%.
La gripe alcanza sus picos de mayor prevalencia durante el invierno, y debido a que el hemisferio norte y el hemisferio sur atraviesan esta estación en diferentes momentos existen, de hecho, dos temporadas de gripe cada año: de octubre a abril en el hemisferio norte y de mayo a septiembre en el hemisferio sur. Este es el motivo por el que la OMS (asesorada por los Centros Nacionales para la Gripe) hace recomendaciones para dos formulaciones vacunales cada año: una para cada hemisferio.[51] Además del clima y la humedad, el estilo de vida de las poblaciones y otros factores están asociados a la aparición de la gripe.[52]
No está completamente claro por qué las epidemias de gripe ocurren de esta forma estacional y no de manera más uniforme a lo largo de todo el año. Una posible explicación es que el contacto interpersonal es más estrecho en invierno debido a un mayor tiempo de vida en el interior de domicilios y edificios, y esto facilitaría una transmisión del virus de persona a persona. Otra explicación es que las temperaturas más altas de los meses de verano y la mayor sequedad del aire limitaría la expulsión del moco por deshidratación del mismo, dificultando la transmisión a través del mecanismo de aerosol que se da durante la tos o el estornudo. El virus también puede sobrevivir mucho más tiempo en los fomites (objetos y superficies transmisores como pomos de puertas, encimeras...) cuando el ambiente es más frío. Los desplazamientos poblacionales durante las vacaciones de Navidad en el hemisferio norte también podrían jugar algún papel.[53] Un factor que puede contribuir al fenómeno estacional es que la transmisión a través del aerosol mucoso es mayor en ambientes fríos (por debajo de 5 °C) y escasa humedad relativa.[54] Sin embargo, los cambios estacionales en las tasas de infección se dan también en regiones tropicales y estos picos de infección pueden verse principalmente durante la temporada de lluvias.[55] Los cambios estacionales en las tasas de contacto durante los períodos escolares parecen jugar un rol más importante que en otras enfermedades escolares como el sarampión y la tos ferina. Una combinación de estos pequeños factores estacionales puede verse amplificada por fenómenos de resonancia dinámica con los ciclos endógenos de enfermedades regionales.[56]
No se conoce el mecanismo por el cual el virus subsiste entre los brotes epidémicos y se han sugerido dos hipótesis:
- El reservorio es humano y hay una prevalencia interepidémica tan escasa que no es detectable y por ello no se puede actuar contra él.
- El reservorio es animal, probablemente en los cerdos hacinados.
Pandemias
En las pandemias, y así se definen, la epidemia progresa hasta afectar a todo el planeta. Las cinco últimas, del siglo XX, han sido causadas por virus de la cepa A, con la aparición de los subtipos:
- 1900-1901: A(H3N8)
- 1918-1919: A(H1N1) (gripe española) con 50 a 100 millones de muertes
- 1957-1958: A(H2N2) (gripe asiática) con 70.000 fallecimientos
- 1968-1969: A(H3N2) (gripe de Hong Kong) 47.000 fallecimientos
- 1977: A(H1N1) (gripe rusa).
- 2009-2010: : A(H1N1) (neogripe A).
Las tres últimas pandemias se originaron en Asia, avanzaron hacia occidente y pasaron a América.
Las pandemias tienen características comunes:
- aparición de un nuevo virus gripal de cepa A (en lo que corresponde a los antígenos hemaglutinina, neuraminidasa o ambos)
- existencia de población mundial sin inmunidad previa por ser un virus nuevo.
- alta capacidad infectiva (trasmisión) de la cepa.
La letalidad acumulada de las epidemias supera, en mucho, a la de las pandemias.
Diagnóstico
Síntomas y signos
La infección con virus de influenza puede ser asintomática y subclínica sin interferir en la capacidad laboral pero con plena infectividad. Son casos en los que el portador, y también transmisor, no es consciente de la enfermedad. Esto es muy frecuente en la gripe por virus C y mucho más raro en los tipos A y B.

En los seres humanos los síntomas de la gripe tienen una aparición más brusca, y son más graves y más duraderos que los síntomas del resfriado común. La recuperación completa se logra en una o dos semanas. En ocasiones puede ser mortal, especialmente en pacientes debilitados (por ser ancianos o enfermos crónicos) o con déficiencia inmunológica.[20] La gripe puede agravar patologías crónicas previas: pacientes con enfisema, bronquitis crónica o asma pueden presentar episodios de disnea durante la fase aguda de la gripe y también puede agravarse una patología coronaria previa o descompensarse un cuadro de insuficiencia cardíaca.[57] El tabaco es otro factor de riesgo que se asocia con cuadros más graves y un incremento de la mortalidad, pero no por su acción directa en la patogenia sino por las lesiones enfisematosas y bronquíticas, previas y subyacentes por él motivadas.[58]
Los síntomas de la gripe comienzan de manera brusca (por ello se suele recordar incluso la hora exacta de aparición): entre 18 o 72 horas (periodo de incubación muy corto) tras el contacto con el virus y la infección. Los primeros síntomas suelen ser estornudos con sensación de resfriado, fiebre alta de hasta 39 °C, cansancio intenso (astenia), con dolores musculares y articulares. El malestar general suele provocar el encamamiento del paciente durante dos o tres días, con dolores musculares generalizados (de mayor intensidad en espalda y piernas) y con persistente dolor articular, más intenso en ambas rodillas.
Los síntomas (lo que refiere el paciente en la anamnesis) más habituales son:
- Dolor, especialmente en las articulaciones (de más a menos en rodillas, codos y hombros), y en la musculatura dorsolumbar y de las extremidades (es el "trancazo").
- Odinofagía (dolor faríngeo sólo con deglutir saliva) con sensación de sequedad en la garganta.
- Tos generalmente seca o no productiva. La abundante mucosidad sugiere complicación traqueal o parenquimatosa.
- Congestión nasal con estornudos y rinorrea (producción de mucosidad) transparente.
- Fiebre con escalofríos. Es alta (38 °C llegando a 41 °C) y dura entre uno y siete días, siendo sólo 3 lo habitual (se denomina V gripal a la gráfica térmica bifásica en la que tras un brusco descenso vuelve a subir en los días cuarto y quinto en ausencia de complicación.
- Cefalea fija, no pulsátil, que es sólo consecuencia de la fiebre.
- La epiforia (lagrimeo) es habitual.
- Dolor retroocular que no suele referir espontáneamente el paciente, pero que le aparece al pedirle que lateralice la mirada (este síntoma es muy característico de la gripe).
- Disnea que sólo suele producirse si hay patología respiratoria previa.
- Expectoración pero generalmente solamente al final del periodo febril y parte de la convalecencia.
- Dolor retroesternal leve relacionado con la necrosis del epitelio traqueal.
- Dolor abdominal (más habitual en niños con infección por virus del tipo B).[59]
Los signos (que se evidencian con los 5 pilares de la exploración física: inspección, palpación, percusión, olfatación y auscultación) más frecuentes son:
- Irritación ocular
- Congestión de la mucosa orofaríngea
- Enrojecimiento de la piel, especialmente en la cara.
- Los ganglios linfáticos cervicales están sensibles pero sin agrandamiento.
- Olor a cetona del aliento por la lipolísis, tras fiebre intensa y mantenida.
- Auscultación torácica generalmente normal pero ocasionalmente (8-40%) hay roncus y sibilancias y pocas veces estertores crepitantes.
- Bradicardia relativa, menos frecuente que en la fiebre tifoidea.
Sensibilidad y especificidad en los síntomas
Investigaciones sobre los síntomas y signos de la gripe han demostrado que los mejores indicadores para el diagnóstico de gripe son:[60]
| Hallazgo: | Sensibilidad | Especificidad |
|---|---|---|
| Fiebre | 86% | 25% |
| Tos | 98% | 23% |
| Congestión nasal | 70–90% | 20–40% |
Notas de la tabla:
- La sensibilidad es la probabilidad de clasificar correctamente a un individuo enfermo. Por ejemplo, el 86% de los pacientes con gripe presentaban fiebre.
- La especificidad es la probabilidad de definir de forma correcta a un individuo sano. En otras palabras, la mayoría (el 75%) de la gente con fiebre no tenía gripe.
- Todos estos hallazgos, especialmente la fiebre, fueron menos sensibles y específicos en personas por encima de los 60 años.
Dado que los fármacos antivirales son más eficaces en los primeros estadios de la enfermedad (primeras 48 horas) es importante el diagnóstico precoz de la gripe. La evaluación combinada de los diferentes síntomas listados más arriba puede mejorar la eficacia del primer diagnóstico.[61] No obstante incluso evaluando la aparición combinada de síntomas se producen errores en el diagnóstico, por lo que en ocasiones se recurre al teorema de Bayes como herramienta estadística para afinar el diagnóstico, aunque hay que tener en cuenta que su aplicabilidad varía con la prevalencia de la gripe en el momento de su aplicación: es decir, durante una epidemia de gripe o en pleno invierno es más probable que determinada combinación de síntomas apunten a una gripe que, por ejemplo, en pleno verano y sin casos de gripe en la comunidad.[62] Usando los datos de los CDC (Centros para el Control de Enfermedades-Centers for Disease Control-), la siguiente tabla muestra como la probabilidad de gripe varía con su prevalencia:
| Combinaciones de síntomas y signos | Sensibilidad | Especificidad | Como se reportó en el estudio[60] y previstos durante las epidemias locales de gripe (prevalencia=66%) |
Previstos durante la temporada de gripe (prevalencia=25%) |
Previstos fuera de temporada de gripe (prevalencia=2%) | |||
|---|---|---|---|---|---|---|---|---|
| VPP (Valor Predictivo Positivo) | VPN (Valor Predictivo Negativo) | VPP | VPN | VPP | VPN | |||
| Fiebre y tos | 64% | 67% | 79% | 49% | 39% | 15% | 4% | 1% |
| Fiebre, tos y dolor de garganta | 56 | 71 | 79 | 45 | 39 | 17 | 4 | 2 |
| Fiebre, tos y congestión nasal | 59 | 74 | 81 | 48 | 43 | 16 | 4 | 1 |
Dos estudios de análisis de decisiones[63][64] han sugerido que durante epidemias locales de gripe, la prevalencia estaría en torno al 70%,[64] y por lo tanto, los pacientes con alguna de las combinaciones de síntomas mencionadas más arriba deberían, (si estuviesen inmunodeprimidos, que es muy improbable), ser tratados con inhibidores de la neuraminidasa sin necesidad de la aplicación del test. Incluso en ausencia de una epidemia local, el tratamiento estaría justificado (según algunos pocos pues el tratamiento sintomático y de sostén suele preferirse dada la escasa eficacia y la toxicidad de los antivirales actuales, salvo en la neogripe A de 2009), en la población anciana durante la temporada "alta" de gripe ya que la prevalencia estaría por encima del 15%.[64]
Diagnóstico diferencial
- Resfriado común: Puede ser difícil diferenciarlo en sus primeras fases,[2] pero normalmente los síntomas de la gripe son de presentación más brusca (es característico que el paciente recuerde incluso la hora exacta en que aparecieron) y son más intensos y duraderos que sus equivalentes en el cuadro catarral.
- Faringitis estreptocócica: Su clínica inicial puede ser similar pero pronto aparecen los exudados purulentos típicos.
- Adenovirus: Sus procesos tienen un inicio progresivo y el dolor faríngeo es mayor
La mayor dificultad diagnóstica, si la epidemia aún no está establecida, puede darse con:
- Enterovirus y arbovirus: Tienen un cuadro clínico apenas distinguible pero por el contrario sin tos. Ambos tipos de virus son, con frecuencia, responsables de la llamada gripe abdominal.
- Dengue: Tiene una clínica (conjunto de síntomas y de signos) muy similar a la de la gripe.
Laboratorio
Analítica general
La VSG está poco acelerada en contraste con la intensidad de los síntomas.
Los leucocitos pueden aumentar al inicio pero lo característico es la leucopenia con linfopenia a partir del segundo día. Una leucocitosis superior a 15000 sugiere complicación bacteriana.
Tests diagnósticos
La disponibilidad de tests de laboratorio para el diagnóstico de la gripe continúa mejorando. Los CDC de los Estados Unidos publican actualizaciones de los test de laboratorio disponibles.[65] De acuerdo con los CDC, el diagnóstico rápido mediante los test de laboratorio disponibles tienen una sensibilidad del 70–75% y una especificidad del 90–95% en comparación con los cultivos del virus. Estos test pueden ser especialmente útiles durante las temporadas de gripe (prevalencia=25%) pero no en ausencia de epidemias locales o en temporada baja (prevalencia=10%).[64]
Los métodos serológicos (los antígenos virales se detectan con inmunofluorescencia o con ELISA) son poco útiles en clínica (pero sí son muy útiles en epidemiologia) pues se requiere una valoración y cuantificación evolutivas y obtener suero de la fase de convalecencia (cuando ya cesó el peligro y se retiró el tratamiento), de manera que es positiva si hay cuadruplicación de las tasas de anticuerpos entre una cuantificación y la siguiente. Se prefiere la prueba de anticuerpos fijadores del complemento a la de la inhibición de la hemaglutinación porque esta última depende de las variaciones de cepa o subtipo.
El test de la PCR en tiempo real (RT-PCR) positivo en la neogripe A determina el paso desde diagnóstico de sospecha a diagnóstico de probabilidad.
El diagnóstico de certeza sólo es posible con la identificación del virus mediante la inoculación de las secreciones faríngeas en cultivos celulares de riñón de mono, o más habitualmente en la cavidad amnial de embriones de pollo.
Tratamiento
Habitual
Los consejos generales para una persona afectada de gripe son reposo, ingesta abundante de líquidos, evitar el consumo de alcohol (licor) y tabaco (en el caso improbable de que le apetezca al paciente, al menos los primeros días) y un fármaco que alivie los síntomas, como el paracetamol, que siendo antitérmico y también analgésico alivia simultáneamente la fiebre y el dolor. Se puede asociar con codeína (salvo en pacientes respiratorios crónicos pues deprime el centro respiratorio) para así evitar la tos pues es improductiva y por lo tanto su supresión no es problemática ya que no provoca acumulo de secreciones. La asociación comercial de paracetamol con codeína no sirve pues la dosis de esta sólo tiene efecto analgésico y no antitusígeno.
La aspirina no está indicada en niños y adolescentes (y el tratamiento previo parece aumentar la susceptibilidad de padecerla) con síntomas de gripe (y tampoco en cualquier otra situación febril) para evitar la aparición del síndrome de Reye, una complicación infrecuente pero grave del hígado y del cerebro que puede afectarles cuando toman este antiinflamatorio en el contexto de algunas enfermedades víricas (especialmente la infección por Influenzavirus B).[66]
La neumonía vírica en su fase grave suele requerir ingreso en cuidados intensivos y requerir medidas de mantenimiento como oxigenoterapia, fluidoterapia, fisioterapia y neumoterapia.
Antibióticos
Dado que la gripe es una infección vírica los antibióticos (fármacos antibacterianos, pero inactivos frente a virus) no mejoran el cuadro, salvo que se prescriban por la aparición de una infección bacteriana secundaria, situación en la que suele ser útil la tinción de Gram y un antibiograma para elegir el antibiótico adecuado.
No se deben administrar con fines profilácticos (preventivos), pues además de su inutilidad, así se seleccionan cepas microbianas multiresistentes.
Antivirales


Los fármacos antivirales tienen una eficacia limitada, tienen toxicidad y los virus pueden desarrollar resistencias a las drogas antivirales más empleadas. Son especialmente útiles en pacientes de alto riesgo cuando la epidemia ya está presente y no hay tiempo para vacunar, así como en brotes nosocomiales.
Los dos tipos principales de antivirales son los inhibidores de la neuraminidasa y los inhibidores M2 (derivados del adamantano).
Inhibidores de la neuraminidasa
Son de primera elección en la infección por el virus de la gripe, aunque el CDC estadounidense recomendó el uso de inhibidores M2 durante la temporada de gripe 2005–06.[67]
Lamentablemente un estudio demostró que la administración del tratamiento antiviral en pacientes con gripe provoca la aparición de resistencia durante la terapia, alterando el pronóstico de la enfermedad. Ello tiene importancia en el impacto que lleva el tratar masivamente a una comunidad (~20% de la población) durante una pandemia, lo cual puede provocar la desastrosa aparición de cepas resistentes durante el período de administración del tratamiento.[68]
El oseltamivir (de nombre comercial Tamiflu) y el zanamivir (Relenza) son inhibidores de la neuraminidasa que han sido diseñados para detener la propagación del virus en el organismo humano.[69] Tienen un rango alto de efectividad tanto frente a Influenzavirus A como B.[70] El grupo colaborativo Cochrane para la gripe ha realizado estudios sobre estos fármacos concluyendo que ayudan a reducir los síntomas y las complicaciones derivadas de la infección.[71] Las diferentes cepas de virus de la gripe presentan resistencias variables a su acción por lo que es imposible predecir qué grado de resistencia se encontrará en una futura pandemia.[72]
Se sabe que el oseltamivir es mucho más vulnerable al desarrollo de resistencias que lo es el zanamivir, debido a la diferencia en su modo de acción.[68] Sin embargo, el zanamivir es un medicamento inhalado, de modo que puede no ser adecuado para el tratamiento de una infección sistémica puesto que las concentraciones del zanamivir, aunque muy buenas en el tracto respiratorio, no alcanzan un efecto sistémico adecuado.[68]
El oseltamivir (de nombre comercial Tamiflu) se usa a dosis profilactica en los casos sospechosos de neogripe A pra pasar a dosis terapeutica cuando el laboratorio confirma el diagnóstico.
Inhibidores M2 (adamantanos)
Los antivirales amantadina y rimantadina han sido diseñados para bloquear un canal iónico (proteína M2) y prevenir así la entrada del virus a las células huésped. Estos fármacos son en ocasiones eficaces frente a Influenzavirus A si se administran precozmente, pero son siempre ineficaces frente al grupo B.[70] La resistencia medida a amantadina y rimantadina en cepas americanas aisladas de H3N2 se ha incrementado hasta un 91% en el 2005.[73] La actividad de los admantanos parece ser poco eficaz contra las cepas H5N1.[68]
Complicaciones
Las complicaciones de la gripe ocurren más a menudo en pacientes mayores de 64 años de edad, así como en aquellos con ciertos trastornos crónicos, como enfermedades cardíacas y pulmonares, diabetes mellitus, hemoglobinopatías, disfunción renal e inmunodepresión.[26] La pulmonía es la complicación más grave de la gripe y puede presentarse como neumonía gripal "primaria", neumonía bacteriana secundaria o neumonía mixta, vírica y bacteriana.
Neumonía vírica
Es la menos frecuente pero la más grave de todas las complicaciones neumónicas.[26] Actualmente sólo aparece en pacientes con bronquitis crónica, enfisema, cardiópatas—generalmente con estenosis mitral—, en deficiencias inmunológicas—como en la diabetes mellitus, SIDA, etc.—y ya más raramente en el embarazo, frecuente en la pandemia de 1918.
Aparece como cuadro gripal que no se resuelve y en el que hay aumento de la fiebre, expectoración escasa pero sanguinolenta, taquipnea con dificultad respiratoria intensa y, finalmente, cianosis central.
El paciente tiende a sentarse en la cama por la aparición de ortopnea, pues respira mejor sentado que estando incorporado.
Como en todas las neumonías atípicas virales no hay consolidación pulmonar completa, los alveolos siguen ventilando y por ello la exploración auscultatoria puede ser anodina, con murmullo vesicular normal.
Contrastando con lo anterior las radiografías de tórax muestran infiltrados muy difusos que son generalmente bilaterales y centrales (perihiliares). Es conveniente pedir la radiografía anteroposterior y también la lateral izquierda para así evaluar mejor la extensión neumónica. La gasometría arterial muestra intensa hipoxia.
El curso suele ser muy grave y el exitus letalis, a pesar de todas las terapias, suele sobrevenir a los 7 días.
Neumonía bacteriana
Las bacterias patógenas más frecuentes son Streptococcus pneumoniae, Staphylococcus aureus y Haemophilus influenzae, que probablemente están previamente en la faringe y causan la infección por disminuir las defensas broncopulmonares durante el cuadro gripal.
La neumonía bacteriana suele comenzar cuando ya hay franca mejoría del cuadro gripal, unos 2-3 días tras el inicio de la enfermedad.[26]
El esputo se hace purulento, la auscultación es de evidente consolidación pulmonar y las radiografías de tórax muestran los signos habituales de la neumonía.
Las bacterias pueden identificar por hemocultivo y menos frecuentemente por cultivo de esputo, pero el virus gripal ya no se puede identificar por haber transcurrido más de una semana desde el inicio de la enfermedad.
El pronóstico es mucho mejor que el de la neumonía vírica dada la habitual eficacia de los antibióticos si se aplican rápidamente, salvo que el germen responsable sea resistente a ellos.
Neumonía mixta
Es un cuadro clínico mezcla de los dos anteriores pues hay empeoramiento en la fase aguda y posteriormente los síntomas son los típicos de la neumonía bacteriana y, quizás, la más frecuente de las complicaciones neumónicas.
La extensión suele ser menor que la habitual en la neumonía vírica y responde bien a los antibióticos, lo que induce a pensar que las bacterias son el agente patógeno predominante.
Síndrome de Reye
En este síndrome hay encefalopatía y degeneración grasa del hígado. Aparece ocasionalmente en la infección por el virus B de la gripe y menos en la infección por el A.[26] También aparece a veces con el virus varicela zoster (VVZ).
Al parecer está relacionado con la administración de aspirina en niños y adolescentes prepuberales (hasta 16-18 años) para el tratamiento de algunas viriasis.
Hay náuseas y vómitos durante uno o dos días, seguidos de trastornos mentales, desde letargia a coma, con hepatomegalia (aumento del tamaño del hígado) y elevación de los niveles en el suero sanguíneo de las enzimas aspartato aminotransferasa (GOT), alanina aminotransferasa (GPT) y LDH en sangre, pero permaneciendo la bilirrubina normal y sin presentar ictericia.
La mortalidad, que antes era del 40%, actualmente ha descendido al 10%. En las autopsias de pacientes fallecidos del síndrome de Reye no se suele encontrar el virus ni en cerebro ni en hígado.
Otras
Otras complicaciones menos frecuentes descritas en asociación con la gripe incluyen:
- Traqueitis.
- Exacerbación de bronquitis crónica, que con frecuencia evoluciona a descompensación e insuficiencia respiratorias.
- Sinusitis y otitis media, que tienen la sintomatología y requieren el tratamiento habitual.
- Musculares, como la miositis, rabdomiólisis y como consecuencia mioglobinuria.
Ya más raramente, pero que sí fueron frecuentes en la pandemia de 1918, pueden presentarse:
Otras complicaciones neurológicas, de presentación muy ocasional, son parálisis de pares craneales, mielitis, sordera, afasia, hemiplejía, síndrome de Guillain-Barré y psicosis, pero la relación con el proceso gripal no está totalmente demostrada.[26]
Pronóstico
La mayoría de las personas que contraen la gripe se recuperan en una o dos semanas (una de enfermedad y otra de convalecencia), pero algunas desarrollan complicaciones graves como neumonía.[52] Según la OMS: "Cada invierno, diez millones de personas contraen la gripe. La mayoría sólo enferman y se ausentan del trabajo durante una semana, pero la población anciana presenta un mayor riesgo de complicaciones mortales. Sabemos que la cantidad de fallecimientos anuales es de unos cientos de miles de individuos, pero incluso en los países desarrollados las cifras son inciertas porque las autoridades médicas no suelen verificar quién muere realmente a consecuencia de la gripe y no de otros cuadros parecidos."[74] Incluso la población sana puede verse afectada y a cualquier edad pueden producirse complicaciones graves. El grupo de población de personas por encima de los 50 años, los niños pequeños y la población de cualquier edad con patología crónica tienen mayor riesgo de padecer esas complicaciones, como neumonía, bronquitis, sinusitis u otitis.[75]
Prevención
Los suplementos vitamínicos se han demostrado inútiles tanto los de vitamina C (inocua pues la sobrante se suele eliminar por orina) como de vitamina D, con la que hay que llevar más cuidado pues al ser liposoluble y no hidrosoluble puede acumularse y provocar intoxicación si se dan dosis altas.
Vacunación
Se han realizado varios estudios con el objetivo de demostrar la inmunogenicidad de la vacuna inactivada contra la gripe. En 1976 se encontró que dicha inmunidad persistía al cabo de tres años posterior a la vacunación del tipo monovalente A.[76] Un año después se reportó que los individuos vacunados durante una epidemia de influenza tipo A presentaban inmunidad a partir del octavo o noveno día después de la vacunación y persistía al cabo de un año. En 1982 se comprobó la eficacia de la vacuna trivalente en 75 reclutas del ejército italiano y cientos de otros voluntarios de otros países.[76]

Esta próxima temporada la epidemia de gripe se prevé intensa por haber sido leve las dos anteriores dadas las enormes campañas de vacunación de hace dos años cuando se temió una pandemia desde la gripe aviar. Por ello es un año en que se recomienda especialmente la vacunación. En España se espera vacunar al 25 % de la población pues están disponibles 10 millones de vacunas de administración preferentemente intradeltoidea.
La vacunación antigripal está ampliamente recomendada para grupos de alto riesgo[52], que son aquellos en los que las complicaciones de la gripe pueden ser graves:
- Mayores de 60 años
- Menores de 5 años
- Inmunodeprimidos (diabetes, SIDA, trasplantados, etc).
- Con enfermedad grave previa especialmente respiratoria (enfisema, bronquitis etc) o cardiaca (infarto de miocardio, valvulopatías, insuficiencia etc).
Además de los grupos de riesgo es habitual la vacunación anual del personal de servicios sociales básicos como médicos, docentes, bomberos o militares.
En general la vacuna se administra a todo aquel con mayor indefensión ante las complicaciones por déficit inmunitario y también a todo aquel que lo solicite dadas sus escasas contraindicaciones (hipersensibilidad o alergia a las proteínas de huevo o a los antibióticos usados en el cultivo de los virus), a fin de dificultar la transmisión todo lo posible.
Las vacunas frente al virus de la gripe pueden fabricarse siguiendo diferentes procesos: el más habitual es el cultivo de virus en proteínas de huevo de gallina. Tras su purificación el virus es inactivado (mediante el uso de agentes químicos (detergentes) o físicos para producir una vacuna que pueden ser de virus íntegros o fraccionados, estas últimas son de elección en niños por ocasionar menor número de reacciones febriles. También pueden realizarse cultivos de virus en proteínas de huevo hasta que pierden su virulencia generando así vacunas.
Las de virus vivos atenuados.[20] para administración nasal son menos aconsejables en inmunodeprimidos.
La eficacia de estas vacunas es variable y no se encuentran grandes diferencias entre las vacunas de virus fraccionado (subvirones) y las vacunas de subunidades, en términos de inocuidad, reactogenicidad e inmunidad en adultos y ancianos.[77]
Debido a la alta tasa de mutación del virus una formulación vacunal concreta confiere inmunidad durante no más de unos pocos años. Cada año la OMS realiza una predicción sobre qué cepa del virus es más probable que sea la causante de la siguiente oleada, permitiendo así a la industria farmacéutica el desarrollo de las vacunas más apropiadas contra esas cepas.[51] Las vacunas también se pueden desarrollar para proteger a las aves de corral de consumo humano de la gripe aviar. Estas vacunas pueden ser eficaces contra múltiples cepas y son usadas junto con el sacrificio selectivo de los animales con mayor riesgo de transmisión de cepas mutadas, como parte de una estrategia de prevención con objeto de evitar o reducir las posibles epidemias y pandemias en humanos.[78]
Es posible estar vacunado y aun así contraer la gripe (uno de cada 5 casos) pues la vacuna tiene una eficacia de alrededor del 80%. La vacuna se elabora antes de cada temporada de gripe para unas cepas específicas pero puede suceder que se produzca la propagación de alguna cepa no prevista o mutada. Se tarda en torno a seis meses en formular y fabricar masivamente una nueva vacuna; en ocasiones una nueva o imprevista cepa se propaga durante ese período y consigue infectar a mucha gente antes de disponer de los millones de dosis vacunales necesarias (como sucedió en la epidemia de gripe Fujian (H3N2) en la temporada de gripe 2003–2004).[79] También es posible infectarse justo antes de la vacunación y enfermar con la cepa supuestamente cubierta por la vacuna, ya que la vacuna tarda unas dos semanas en lograr su máxima efectividad.[75]
La temporada 2006–2007 fue la primera en la que el CDC recomendó la vacunación anual de los niños menores de 5 años.[80]
Las vacunas contra la gripe son seguras y rara vez se reportan efectos adversos. Los efectos secundarios más frecuentes son dolor, enrojecimiento y leve edema en el sitio de la inyección (20 %), dolor de cabeza, malestar y debilidad generalizada. Con menos frecuencia se han observado mareos e hipotensión. En 1-2 % de los casos hay fiebre y síntomas constitucionales. Puede causar también reacciones inmunitarias que se asemejan a una infección real por el virus, o a síntomas generales de infección (muchos síntomas catarrales o gripales son, en realidad, síntomas generales inespecíficos de infección), aunque de una manera leve y transitoria.
Los casos más graves incluyen reacciones alérgicas y broncoespasmo.[77] por reacción frente a alguno de los componentes de la vacuna (residuos de las proteínas del huevo o de los antibióticos empleados para su elaboración); no obstante este tipo de reacciones son extremadamente infrecuentes.[81]
Higiene y asepsia en el control de la infección
Unos adecuados hábitos personales de higiene son eficaces también para la prevención de la infección. Las personas que han contraído la gripe son más infectivas durante el segundo y tercer día tras haberla contraído y su capacidad infectiva se prolonga durante unos diez días.[82] Los niños son especialmente infectivos (más que los adultos) y pueden propagar partículas víricas desde antes incluso de la aparición de sus síntomas, y hasta dos semanas después.[82][83]
Dado que la gripe se contagia a través de las gotas emitidas en aerosol con la tos, el estornudo e incluso con el habla, y a través del contacto con superficies contaminadas, es de especial importancia recomendar a la población que se cubra la cara cuando tosan o estornuden, así como el lavado frecuente de manos.[80]
La desinfección de superficies está recomendada en las zonas en las que pueda depositarse el virus.[84] El alcohol es un eficaz desinfectante del virus de la gripe y si se usa junto con sales cuaternarias de amonio se incrementa notablemente su eficacia.[85] En los hospitales las sales cuaternarias de amonio y diversos compuestos halogenados, como el hipoclorito de sodio son habitualmente empleados para la desinfección de zonas sanitarias y equipamiento médico que han sido ocupados o usados por pacientes con síntomas de gripe.[85]
En anteriores pandemias el cierre de colegios, iglesias y teatros ralentizó la propagación del virus pero no parece haber tenido una influencia significativa en la disminución de la tasa de mortalidad.[86][87]
Investigación

Las investigaciones sobre el virus de la gripe se están centrando en estudios de virología molecular, acerca de cómo el virus desencadena los mecanismos patogenéticos de la enfermedad, en la respuesta inmunológica del huésped, en la genómica viral y en la manera en que el virus se propaga provocando oleadas epidémicas. Estos trabajos están ayudando a desarrollar medidas de lucha más eficaces contra el virus; por ejemplo, un mejor conocimiento de la respuesta inmunitaria del organismo ayuda al desarrollo de mejores vacunas, y un conocimiento detallado de cómo el virus penetra en las células diana mejora el diseño de los nuevos fármacos antivirales. Un importante programa básico de investigación es el Influenza Genome Sequencing Project (Proyecto de Secuenciación del Genoma del virus de la Gripe), que está creando una base de datos de secuencias genéticas del virus; esta base de datos ayudará a clarificar qué factores influyen en la mayor mortalidad o virulencia de una cepa determinada frente a otra, qué genes están involucrados en la mayor o menor inmunogenicidad y cómo el virus evoluciona en el tiempo.[88]
La investigación de nuevas vacunas es especialmente importante, ya que las actuales son lentas y caras de producir y deben ser reformuladas cada año. La secuenciación del genoma del virus de la gripe y el uso de la tecnología de recombinación genética pueden acelerar la aparición de la siguiente generación de cepas vacunales, permitiendo a los científicos colocar nuevos antígenos en cepas de vacunas previamente desarrolladas.[89] Nuevas tecnologías están siendo también desarrolladas para permitir el crecimiento de virus directamente en cultivos celulares, mejorando las vacunas y disminuyendo los costes.[90] La búsqueda de una vacuna universal para el tipo A, dirigida contra la superficie externa de la proteína transmembrana M2 (M2e), está siendo llevada a cabo en la Universidad de Gante por Walter Fiers, Xavier Saelens y su equipo[91][92][93] y ha concluido con éxito la Fase I para ensayos clínicos.
Infección en animales
| Casos de gripe aviaria tipo A (H5N1) confirmados en humanos Hasta el 10 de marzo de 2006 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| País | Fechas reportadas | Total | |||||||||||||
| 2003 | 2004 | 2005 | 2006 | ||||||||||||
| casos | muertes | casos | muertes | casos | muertes | casos | muertes | casos | muertes | ||||||
| 4 | 4 | 100 % | 4 | 4 | 100 % | ||||||||||
| 8 | 5 | 62.5 % | 7 | 5 | 71.4 % | 15 | 10 | 75.0 % | |||||||
| 17 | 11 | 64.7 % | 11 | 10 | 90.9 % | 28 | 21 | 75.0 % | |||||||
| 2 | 2 | 100 % | 2 | 2 | 100 % | ||||||||||
| 17 | 12 | 70.6% | 5 | 2 | 40.0% | 22 | 14 | 63.6% | |||||||
| 12 | 4 | 33.3% | 12 | 4 | 33.3% | ||||||||||
| 3 | 3 | 100 % | 29 | 20 | 69.0% | 61 | 19 | 31.1% | 93 | 42 | 45.2% | ||||
| Total | 3 | 3 | 100 % | 46 | 32 | 69.6% | 95 | 41 | 43.2% | 32 | 21 | 65.6% | 176 | 97 | 55.1% |
| Fuente Organización Mundial de la Salud (OMS) : Communicable Disease Surveillance & Response (CSR). | |||||||||||||||
El virus de la gripe puede infectar a numerosas especies animales y producirse una transferencia de cepas virales entre ellas. Las aves son el principal reservorio animal del virus.[94] Se han identificado hasta dieciséis variedades de hemaglutinina y nueve de neuraminidasa. Todos los subtipos conocidos (HxNy) pueden aislarse en pájaros, pero muchos subtipos son endémicos de otras especies como humanos, perros, caballos y cerdos; en poblaciones de camellos, hurones, gatos, focas, visones y ballenas también se ha demostrado la existencia de infección o exposición al virus.[33] Algunas variedades del virus se nombran en función de la especie a la que la cepa está adaptada o de la que es endémica. Las principales cepas nombradas usando esta convención son la gripe aviar, la gripe humana, la gripe del cerdo, la gripe del caballo y la gripe del perro. Con el nombre de gripe del gato se hace referencia normalmente a un tipo de rinotraqueitis vírica propia de los felinos o a la infección por calicivirus, pero exactamente a la infección por alguna de las variantes del influenzavirus. En los cerdos, los caballos y los perros los síntomas suelen ser similares a los humanos, con tos, fiebre y pérdida del apetito.[33] La existencia de pandemias en animales no está tan bien estudiada como en humanos pero está registrada una epidemia de gripe en una población de focas de la costa de New England, causando aproximadamente unas 500 muertes en 1979–1980.[95] Por otra parte, las epidemias en cerdos son habituales y no suelen provocar gran mortandad.[33]
Los síntomas de la gripe en las aves son variables y pueden ser inespecíficos.[96] Los síntomas de una infección poco patógena pueden ser tan leves como algunas plumas encrespadas, una pequeña reducción en el número de los huevos de cada puesta o una discreta pérdida de peso con algunos leves síntomas respiratorios.[97] Estos síntomas leves e inespecíficos dificultan el diagnóstico de campo, siendo necesaria la realización de test de laboratorio para el diagnóstico de aves infectadas. Algunas cepas como la asiática H9N2 son extremadamente virulentas con las aves de corral y pueden causar síntomas más graves y mayor mortalidad.[98] En sus variantes más patógenas, la gripe en los pollos y los pavos provoca la aparición repentina de un cuadro grave con una mortalidad cercana al 100% en cuarenta y ocho horas.[99] Dado que el virus se propaga con mucha rapidez en condiciones de hacinamiento propias de las granjas intensivas de estas aves, estas epidemias pueden causar grandes pérdidas económicas.
Una cepa muy patógena de H5N1 adaptada a las aves (llamada HPAI A(H5N1), de las siglas en inglés "Highly Pathogenic Avian influenza virus tipo A, subtipo H5N1": Virus de la gripe aviar tipo A altamente patogénico) provoca la gripe aviar, endémica de muchas poblaciones de pájaros, especialmente en el sudeste asiático. Esta cepa asiática de HPAI A(H5N1) se está extendiendo por todo el mundo. Es epizoótica (epidémica en animales) y panzoótica (puede causar epidemias en múltiples especies animales y en amplias áreas geográficas), matando decenas de millones de aves y provocando el sacrificio de cientos de millones más para controlar la extensión de la enfermedad. La mayoría de las referencias en los medios de comunicación sobre la gripe aviar y la variante H5N1 son sobre esta cepa específica.[100][101]
Por el momento HPAI A(H5N1) provoca una enfermedad en las aves, y no existen evidencias de transmisión de humano a humano. En casi todos los casos de infección en humanos se había producido un estrecho contacto físico con aves infectadas.[102] Se desconoce si en el futuro esta cepa podrá mutar hacia una estirpe capaz de transmitirse entre humanos. Debido a su gran virulencia y letalidad, a su presencia endémica y su extensa distribución en el reservorio biológico aviar, el virus H5N1 disparó las alarmas de pandemia en la temporada de gripe 2006–07, y se está invirtiendo una gran cantidad de recursos económicos en prepararse para una potencial pandemia de gripe a nivel mundial.[103] (P) En abril del 2009 esta habiendo una pandemia en varios estados de México, en California, Texas, New York, Nuevo México(/P)
Impacto económico
Gripe humana
La influenza es una enfermedad que produce altos costos para el individuo y las naciones debido a la pérdida de productividad y al tratamiento médico asociado a la enfermedad, así como costos indirectos de las medidas preventivas.
El impacto económico de las pandemias del pasado no se han estudiado con intensidad, a tal punto que algunos autores han sugerido que la influenza española más bien tuvo un efecto positivo a largo plazo en el crecimiento económico per cápita, a pesar de la gran reducción en la población trabajadora y los efectos represivos a corto plazo.[104]
Otros estudios han intentado predecir los costos asociados a pandemias tan graves como la gripe española de 1918, las repercusiones sobre los países donde el 30% de los trabajadores se enfermen y 2,5% de ellos mueran. Se estima que una tasa de morbilidad del 30% para una enfermedad que dure 3 semanas debe disminuir el Producto Nacional Bruto en un 5%. Los costos adicionales provenientes del tratamiento médico de 18 - 45 millones de personas sumarían unos 700 mil millones de dólares.[105]
Gripe aviar
Los costos de la prevención de la enfermedad son igualmente elevados. Diferentes gobiernos alrededor del mundo han gastado millones en la preparación y planificación de una potencial pandemia de gripe aviar, con costos asociados a la compra de vacunas, así como en el desarrollo de planificación de desastres y estrategias para la mejora del control de fronteras.[103] Por ejemplo, el 18 de enero de 2006, durante una conferencia internacional en China, varias naciones internacionales prometieron recaudar 2 mil millones de dólares para combatir la gripe aviar.[106]
Para 2006, se habían gastado más de diez mil millones de dólares y se habían sacrificado más de 200 millones de pájaros con el fin de tratar de contener el virus aviar H5N1.[107] Sin embargo, todos estos esfuerzos han sido ineficaces en el control de la dispersión del virus, de modo que se han intentado distintos abordajes. Por ejemplo, en Vietnam, el gobierno adoptó en 2005 una combinación masiva de vacunación, desinfección, desecho de aves y campañas informativas en las ciudades con producción comercial de aves.[108] Como resultado de estas medidas, el costo de criar aves ha aumentado en ese país, mientras que el precio para el consumidor ha disminuido porque la demanda ha caído por debajo de lo surtido. Ello ha causado pérdidas devastadores a los criaderos de aves, quienes no pueden costear las medidas demandadas por el gobierno. La crianza multinacional de aves se ha vuelto un mercado improductivo a medida que la gripe aviar se vuelve endémica en las aves salvajes alrededor del mundo.[109] La ruina financiera de los criadores de aves más pobres es tan severa que les amenaza con inanición, a tal punto que algunos han cometido suicidio y otros han dejado de cooperar con las medidas gubernamentales en el control del virus, aumentando aún más el riesgo humano de contagio y la probabilidad de una mutación pandémica.[110][111]
Gripe A (H1N1) de 2009
La Cámara de Comercio de México D.F aseguró que las pérdidas fueron de aproximadamente $57 millones diarios durante la primera semana.[cita requerida]
Brote de gripe A (H1N1) de 2009
Un brote extremadamente virulento, pues inicialmente se informó una elevada tasa de mortalidad (del 10 al 20 %- en México, cuando en la gripe estacional suele ser de solo el 0,1 %) fue reportado el 22 de abril de 2009, con la sorprendente característica de afectar predominantemente a jóvenes sanos, y no a ancianos o niños como había sido lo habitual en esta enfermedad, salvo en la pandemia de la gripe española de 1917, la cual afectó también más a los jóvenes.
En tan sólo una semana la cepa recién identificada se confirmó en USA, Canadá, Reino Unido, España, Nueva Zelanda e Israel y también se confirmaron casos de contagio interhumano, ya fuera de México.
Inicialmente se le denominó gripe porcina por su probable origen genético, pero tal denominación se ha evitado ya que induciría a pensar que el cerdo o los productos porcinos son transmisores del virus, cuando la realidad es que la gripe es solo transmisible por vía aérea (para lo cual se requiere cercanía inferior a 2 metros hasta el contagiado que tosa o estornude), por fomites (objetos contaminados como vasos, pomos de puertas etc.) y por contacto íntimo (beso).
Una cepa viral recombinante de virus A subtipo H1N1 es la responsable de la primera pandemia gripal del siglo XXI, que ya era esperada en el transcurso de los últimos 10 años, según las predicciones estadísticas de la OMS.
Al parecer, tras los primeros análisis, se ha determinado que contiene material genético tanto de cepa porcina como de humana y también de cepa aviar, en una combinación totalmente novedosa. Hemos de recordar que el cerdo puede verse afectado tanto por las cepas porcinas como por las humanas y las aviares, por lo que una infección simultánea de las tres o de sus recombinantes, puede provocar una nueva recombinación genética, con un diferente grado de agresividad.
Un grupo de científicos, dirigido por Rebecca Garten, han secuenciado más de 50 muestras de virus, aislados en México y en los Estados Unidos, demostrando su escasa relación con las cepas previas, pues la combinación genética no se había descubierto antes entre los virus de la gripe porcina o humana. La interpretación más tranquilizadora, entre otras, es que sus genes han estado circulando durante un largo periodo de tiempo en los animales, tal vez cerdos, sin haber sido nunca detectados.
El virus causante de la gripe española de 1917-1918, cuyo genoma se ha estudiado en virus extraídos de cuerpos de víctimas sepultados en zonas de hielo permanente [6], pertenecía también A subgrupo H1N1. El 6 de febrero de 2004 se publicó en la prestigiosa revista científica Science un artículo de dos grupos de investigadores sobre ADN obtenido del pulmón del cádaver de una mujer esquimal encontrado en la tundra de Alaska y de otras muestras tisulares preservadas de soldados americanos de la I Guerra Mundial y el 5 de octubre de 2005 también en Science, se publicó la reconstrucción del virus de la gripe de 1918 (H1N1). El virus fue totalmente reconstruido in vitro por el grupo de Jeffrey Taubenberger y su agresividad fue estudiada en embriones de pollo, en cobayas y en células pulmonares humanas para descubrir los elementos que lo hicieron tan mortífero y se concluyó que la virulencia era función de la mutación de unos pocos genes, con alteraciones en 25 o 30 aminoácidos de los 4.400 que componen el virus.
Por ello es incorrecto denominar al actual brote como gripe porcina o como gripe A (H1N1), pues también la pandemia de gripe española de 1918 y la epidemia de gripe rusa de 1977 fueron A (H1N1). La OMS recomienda, por ello, denominar al nuevo virus como nueva gripe A o neogripe A (H1N1).
Cursa como una gripe normal (tos, rinorrea, fiebre alta, cefalea, dolor ocular y faríngeo, artralgias y astenia) pero ocasionalmente puede evolucionar rápidamente (en unos 5 días) a neumonía atípica (neumonía vírica que presenta escasos signos en la exploración física pero que es muy evidente a RX) con dificultad respiratoria aguda fulminante en la mitad de los casos.
La neogripe A está afectando principalmente a los adultos jóvenes y sanos. Esto se ha querido interpretar como motivado por la existencia de inmunidad cruzada con alguna epidemia anterior, con la que habrían tenido contacto la población que ahora parece más protegida (los mayores de 55 años). Esta explicación es poco compatible con la escasa huella inmunológica que suele dejar el virus gripal, dada su mutabilidad, pero ha sido confirmada por el Dr. Daniel Jernigan, jefe de epidemiología gripal en el Centers for Disease Control and Prevention de USA tras demostrarse que gente mayor de esa edad posee anticuerpos que atacan el nuevo virus [7]. Es muy probable que haya inmunidad cruzada con la epidemia de gripe rusa de 1977 (no confundir con la pandemia rusa) que también fue del subgrupo A-H1N1 y que a su vez tenía inmunidad cruzada con cepas A-H1N1 de los años cincuenta, pero ello no implica, en absoluto, que todos los mayores de 55 años sean inmunes al nuevo virus.
Al parecer la contagiosidad solo es de una semana, pero se ha reportado que los niños y los pacientes inmunodeficientes pueden propagar el virus durante más de 10 días.
La gripe estacional tiene una "tasa de ataque secundario", que es el porcentaje de contactos que la contraen desde una persona infectada, de entre el 5 y el 15 por ciento, según datos de la OMS, pero en la neogripe A la tasa es superior al 30 % pues su contagiosidad es alta.
Diagnóstico (según el protocolo europeo)
De sospecha
Se sospechará ante ( A ó B ó C) + (1 ó 2 ó 3 ) , es decir, ante:
A) Fiebre (más de 38 °C con signos y síntomas de infección respiratoria grave.
o ante
B) Neumonía
o ante
C) Fallecimiento por una enfermedad respiratoria aguda de etiología desconocida.
Ello, unido a uno de los 3 siguientes antecedentes obtenidos en la anamnesis, referidos a los 10 días previos:
1. Estancia, en zona donde se han reportado casos humanos A-H1N1
2. Haber tenido contacto, con una persona ya diagnosticada de gripe A-H1N1 (en los viajes en avión se considerarán contactos a los pasajeros de las hileras de asiento anterior, posterior y contralateral).
3. Haber tenido contacto con animales sospechosos de infección por el A-H1N1 o trabajar en laboratorio manipulando muestras posiblemente contaminadas con el virus de la neogripe A.
De probabilidad
Cuando tras el diagnóstico de sospecha se realiza y resulta positivo el test diagnóstico de la PCR en tiempo real (RT-PCR).
De certeza
Los casos sospechosos se verificarán tras tomar muestras de:
- Aspirado o exudado nasofaríngeo, con hisopos sintéticos.
- Suero, tanto de la fase aguda como de la fase convaleciente (dos semanas después del inicio del cuadro).
- Biopsia o necropsia de pulmón.
Las muestras se analizaran en le centro de referencia previamente designado por las autoridades sanitarias.
Tratamiento
Profiláctico
En los casos sospechosos se procederá disponiendo:
- Habitación hospitalaria individual con total aislamiento y si el aislamiento es domiciliario permanecerá en su habitación el mayor tiempo posible y con mascarilla quirúrgica si hay convivencia.
- Reportación inmediata a las autoridades sanitarias.
- El personal sanitario deberá usar mascarillas protectoras (mascarilla con filtro FFP2), y si no están aún disponibles estas se utilizarán las quirúrgicas habituales. Son convenientes las gafas o protector facial completo.
- El tratamiento profiláctico se realizará, incluso sin confirmación diagnóstica del laboratorio, con oseltamivir, el cual es más eficaz si se administra en las primeras 48 horas tras la exposición. El tratamiento deberá prolongarse durante 10 días. La dosis dependerá del peso del paciente (menos de 15 kg, 15-23, 24-39, más de 40 kg.)
- Hay que censar y localizar los contactos próximos recientes.
Resolutivo
Afortunadamente el virus es sensible al oseltamivir y al zanamivir pero es totalmente resistente a la amantadina, rimantadina y similares.
Determinar la dosis y la posología corresponde al personal médico pues son fármacos no exentos de efectos perniciosos como el síndrome de Steven Johnson que cursa con eritema polimorfo grave tanto en piel como en mucosas.
Pronóstico
En México el 5 % cursa con neumonía vírica con congestión respiratoria y la letalidad está alrededor del 2 % (lejos de los primeros datos que la cifraban entre el 10 y el 20 por cien y que no fueron confirmados por los laboratorios, pero diez veces superiores a los de la gripe estacional), seguramente por ser una situación nueva y sorpresiva, pero la mortalidad ha sido prácticamente nula en el resto del planeta y la respuesta al tratamiento con inhibidores de la neuraminidasa está siendo satisfactoria.
Vacunación
Al parecer las vacunas disponibles actualmente no son eficaces pues no incluyen esta nueva cepa y no hay inmunidad cruzada entre la neogripe A y las actualmente comercializadas.
En teoría no habrá gran dificultad (al contrario como sucede con otras enfermedades como el SIDA y la malaria) en obtener una vacuna eficaz, pero el conseguirla y fabricarla en las cantidades necesarias va a requerir varios meses.
La evolución de la pandemia de la neogripe A depende en gran medida de la rapidez en la obtención de una vacuna eficaz que es de suponer que esta vez será preferentemente con virus muertos y no con atenuados. Probablemente se necesitarán, acelerando los procedimientos ya muy estandardizados pero obsoletos, unos dos meses, con lo cual sí que estará disponible para el próximo invierno del hemisferio norte, pero los plazos son muy ajustados para el hemisferio sur donde el invierno, que es cuando la propagación de la gripe es facilitada por las condiciones ambientales, ya está muy cerca.
Higiene
La gripe es una enfermedad que se transmite rápidamente tanto en la familia como en los centros de trabajo y de escolarización.
La contagiosidad se inicia 24 horas antes de aparecer los síntomas y se prolonga durante 7 días y en caso de persistir la sintomatología hasta la desaparición de esta, pero en menores de 12 años y en inmunodeprimidos puede prolongarse 3 semanas,
Las medidas profilácticas para la población en general son las higiénicas, las mismas que se describen en la gripe común dado que los mecanismos de transmisión de la neogripe A son muy similares: frecuente lavado higiénico de manos, decoro al toser y estornudar (nunca con la mano delante de la boca pues, no disponiendo de pañuelo grande y desechable, es preferible el antebrazo a la mano), no compartir vasos ni cubiertos, mantener limpios los objetos de uso compartido, evitar los enfermos respiratorios y los cambios bruscos de temperatura. En ausencia de desnutrición los suplementos vitamínicos no han demostrado utilidad alguna.
La vía principal de transmisión son las gotitas de Pflügge (mayores de 4 micras) que se originan al hablar, toser o estornudar y que no suelen alcanzar distancias superiores a metro y medio. En los fomites contaminados el virus puede vivir varias horas. Se recomienda su limpieza con lejía diluida o con alcohol.
Tras regresar de las zonas expuestas se recomienda que si se presenta fiebre, tos o dificultad respiratoria (disnea) se contacte inmediatamente con el servicio de emergencia pertinente (teléfono 112, de emergencias) y no acudir ni a hospitales ni a centros de salud donde se podría contagiar a personal altamente susceptible en pasillos y salas de espera. Ese es el único modo de obtener el antiviral en España pues se ha retirado de las farmacias para evitar su acaparamiento, lo cual se ha mostrado eficaz en la contención de la enfermedad pues obliga a los posibles enfermos a contactar con las autoridades sanitarias para obtener el antiviral, con lo cual el seguimiento epidemiológico se ve facilitado.
Aislamiento
Cuando se requiera cuarentena esta será, pese a su nombre de resonancia medieval, de solo diez días y no de cuarenta, tiempo suficiente para que el cuadro clínico se manifieste, pues la incubación de la enfermedad es muy corta.
Lo habitual, en Europa, es el aislamiento domiciliario salvo casos de evolución dudosa, con restricción de visitas, facilitándole mascarilla quirúrgica, solución hidroalcohólica y bata y pañuelos desechables. Los objetos de uso personal se reducirán al mínimo y la toma de temperatura será cada 12 horas.
Protocolo de interacción
a) Antes de entrar en la habitación de aislamiento:
Se seguirá estrictamente este orden:
1.- Hay que asegurarse de que el paciente tiene puesta la mascarilla.
2.- Ponerse gorro, calzas, gafas y bata desechable.
3.- Colocarse la mascarilla FFP2, ajustándola en nuca, nariz y barbilla.
4.- Poner bote de jabón hidroalcohólico en bolsillo de la bata.
5.- Colocarse los 2 guantes, el de látex y encima el de plástico.
b) Antes de salir de la habitación, al lado del contenedor de residuos y distando más de dos metros del paciente:
1.- Se quitan y arrojan al contenedor por este orden: Guantes de plástico, bata, guantes de látex, gorro y gafas.
2.- Lavar manos con gel hidroalcohólico.
3.- Quitarse mascarilla FFP2, que se guarda para posteriores usos.
4.- Lavar manos con gel hidroalcohólico.
5.- Hay que dejar bien cerrada la puerta al salir.
Epidemiología
El miércoles 13 de Mayo la OMS reconoció públicamente que estaba investigando que el virus se hubiera “fugado” de un laboratorio, tras haber explicitado esa posibilidad Adrian Gibbs, experto australiano en antivirales, pero ya el día siguiente, el jueves 14 de Mayo, Keiji Fukuda, director general para seguridad sanitaria de la OMS declaró que no hay pruebas de que el virus se haya originado en un laboratorio, insistiendo en que es de origen desconocido, pues no se ha identificado ninguna zoonosis desde el punto de vista veterinario en Norteamérica (por el contrario sí que se identificaron aves enfermas de gripe hace unos años), y hasta ahora los únicos cerdos afectados por la enfermedad, en Canadá, lo fueron al contagiarse desde un humano procedente de México (recientemente hubo muchos otros afectados en Oriente Medio, pero no por la enfermedad sino por el alarmismo provocado por una incorrecta traducción de un texto de la OMS). El origen del virus sigue siendo, pues, una incógnita.
Recordemos, no obstante, que al parecer el virus epidémico de 1977 (también un A-H1N1) sí que fue sospechosamente idéntico al de los años cincuenta, cuando de persistir libremente en la naturaleza durante dos décadas las mutaciones debieran haber sido insoslayables. Por ello se le denominó gripe rusa, al suponerse procedente de un laboratorio soviético, pero al parecer se originó en Extremo Oriente.
A mediados de Mayo Japón ha desplazado a España (con un centenar de casos la mayoría ya resueltos, salvo el reciente foco en la Academia Militar de Ingenieros de Madrid, después propagado a otros centros militares) del cuarto lugar en número de afectados y siendo allí la mayoría de casos autóctonos (la mayoría entre estudiantes de secundaria tras contactar en varios eventos deportivos, lo que ha obligado a cerrar miles de colegios) y ya fuera de Norteamérica ello implicaría que la OMS, según sus propias reglas, debería elevar la alerta pandémica al nivel 6 que es el el máximo y que no es función de la gravedad sino de la extensión.
El sábado 17 de Mayo México entregó a la OMS la cepa del virus A H1N1 y la información clínica y epidemiológica de la enfermedad.
La Asamblea General de la Organización Mundial de la Salud (OMS), que comenzó el 18 de mayo en Ginebra en lugar de prolongarse hasta el día 27, tal como estaba previsto, se ha acortado hasta el día 22 para que se pueda regresar antes a los países de origen y así frenar mejor la pandemia.
Los países en desarrollo encabezados por Indonesia, Tailandia, India, Nigeria y Brasil han solicitado un más fácil acceso a las vacunas que se espera sean desarrolladas en los próximos meses solicitando les sea transferida la tecnología para fabricarlas en justa compensación a su colaboración y aporte de cepas para elaborarlas, pero se ha argumentado que no habrá investigación ni producción si las empresas farmacéuticas temen perder los beneficios obtenidos por la venta de dichas vacunas.
El secretario general de la ONU, Ban Ki-moon se desplazó a Ginebra a última hora del lunes día 18 para participar en la asamblea anual de la OMS y mantener entrevistas con los responsables de los principales grupos farmacéuticos de 20 países industrializados sobre el desarrollo de una vacuna contra la neogripe A y se estimó que se pueden llegar a fabricar unos 5.000 millones de vacunas en un año, lo que parece improbable por ausencia de precedentes de tal magnitud. Ban exhortó al mundo a "permanecer vigilante y atento a la menor señal" y remarcó que "aún quedan muchas preguntas sin respuesta sobre el virus".
El archipiélago japonés se ha convertido en la segunda región del mundo más afectada por el virus, detrás de América del Norte lo que obligaría a establecer el nivel pandémico 6 (lo que según los protocolos determinaría el inicio en la fabricación de vacunas) pero varios ministros de Salud como los de Brasil, Japón, China, Suiza y Gran Bretaña, recomiendan a la OMS no precipitarse para evitar alarmismo y pánico, dado que el virus está resultando leve y son pocos los fallecidos. Sostienen, en contra de los criterios previamente establecidos, que llevar la alerta al nivel 6 debería reflejar la gravedad de un nuevo virus y no sólo su expansión geográfica. (La OMS pasó del nivel de alerta 3 al 5 en menos de una semana, lo que se consideró como demasiado apresurado).
La directora general de la OMS, Margaret Chan ha afirmado lo evidente al decir que no se puede descartar que el virus pueda combinarse con otros virus gripales (con lo cual la vacuna tendría que ser diferente a la obtenida desde la actual cepa) y también insistió el martes día 18 de Mayo en que actualmente se debe dar preferencia a la producción de vacunas contra la gripe común, especialmente en el hemisferio sur con un invierno ya inminente, pues la OMS sigue meditando sobre los riesgos que supondría el suspender la fabricación de esta vacuna (contra la gripe estacional que mata a 500 mil personas por año en todo el mundo) para así facilitar la capacidad de los laboratorios para producir la nueva vacuna.
El peor escenario sería el encuentro y recombinación genética, más probable en Asia, del actual virus A (H1N1) con el virus aviar A (H5N1) de tal manera que el virus resultante tomara la letalidad de este (más del 60 %) con la contagiosidad de aquel (más del 30 %). A señalar que si el resultante tuviera la letalidad de la neogripe A y la contagiosidad del aviar sería relativamente fácil frenar su propagación.
Dos tercios del total de vacunas se fabrica en Europa y además Estados Unidos, Canadá, Australia, Japón y China pueden producir sus propias dosis y pese a que todavía la OMS no ha dado la luz verde a las farmacéuticas para comenzar la producción masiva quince países (Canadá, Australia, Nueva Zelanda y 12 europeos) ya preordenaron cerca de 250 millones de dosis.
Los laboratorios (Sanofi, Solvay, GSK, Novartis y otros) han acelerado la producción de la vacuna contra la gripe estacional, por lo que 350 millones de dosis serán suministradas a mediados de junio, y otros 430 millones estarán listas en julio que es cuando se espera que los laboratorios ya estarán listos para iniciar la producción comercial masiva de la nueva vacuna contra la neogripe A-H1N1, que se prevé será más difícil de lo que se consideraba en un principio, y podría estar disponible para setiembre. Se han comprometido a entregar a casi precio de costo el 10% de toda la producción de la vacuna y Margaret Chan, aseguró que ninguna persona será dejada de lado por falta de medios, pero parece claro que los países en desarrollo no constituyen solo el 10 % de la población mundial.
También persiste el temor de que la nueva cepa adquiera resistencia a los antivirales por mutación o por combinación con cepas previas, pues una cepa estacional del A-H1N1 se volvió esta temporada en USA resistente al antiviral más usado, oseltamivir (Tamiflu de Roche) mientras el zanamivir (Relenza de Glaxo Smith Kline, que debe ser inhalado), aún funciona. Otro temor es que en una segunda onda el virus sea más agresivo ya que la gripe española mató a más de 40 millones de personas durante una segunda onda ocurrida durante setiembre en el hemisferio norte.
Por otro lado los 118 miembros de la coalición de países no alineados, pidieron que el temor a una hipotética pandemia de neogripe A unido a la crisis económica global, no reste financiación a la lucha contra otras enfermedades que están muy expandidas en sus poblaciones, como las tropicales, la tuberculosis, la malaria y el sida, que causan millones de muertos cada año.
En una pandemia gripal es de prever que un tercio de la población sufra la enfermedad en el primer o en el segundo año lo que implica que con una letalidad del 0.3% al 0.6% la mortalidad sería de 6 a 12 millones. El objetivo actual de la OMS es contenerla para dar tiempo a la fabricación de la vacuna, usando los antivirales racionalmente para evitar la aparición de resistencias dado que no hay actualmente ninguna alternativa terapéutica a los inhibidores de la neuraminidasa.
El alarmismo inicial está cediendo actualmente dado que con el tratamiento adecuado los cuadros clínicos suelen ser leves y la evolución de los pacientes está siendo muy buena, pero Margaret Chan, durante la clausura de la asamblea anual de la OMS. ha advertido que los países deberían prepararse para más contagios graves del virus A-H1N1 y para más muertes por la nueva gripe y ha advertido que el virus es traicionero y que podría ser el azote de los países emergentes del hemisferio sur. Ya el pasado día 5 de mayo, sin ningún miedo a equivocarse, Chan afirmó “Puede que en un mes este virus desaparezca, puede que se quede como está o puede que se agrave”. (olvidó, evidentemente y en buena lógica, la posibilidad de que disminuya sin llegar a desaparecer...).
Referencias
- ↑ a b c Merck Sharp & Dohme de España, S.A. (2005). «CAPITULO 186. Infecciones víricas». Manual Merck de información médica para el hogar. Consultado el 25, 09
|fechaacceso=y|Añoacceso=redundantes (ayuda). - ↑ a b c Eccles, R (2005). «Understanding the symptoms of the common cold and influenza». Lancet Infect Dis 5 (11): 718-25. PMID 16253889. doi:10.1016/S1473-3099(05)70270-X.
- ↑ Kristina Duda, R.N (22 de diciembre de 2006). «Seasonal Flu vs. Stomach Flu». About.com, forma parte de The New York Times Company (en inglés). Consultado el 1, 10
|fechaacceso=y|Añoacceso=redundantes (ayuda). - ↑ Reid AH, Fanning TG, Hultin JV, Taubenberger JK (1999). «Origin and evolution of the 1918 "Spanish" influenza virus hemagglutinin gene». Proc. Natl. Acad. Sci. U.S.A. 96 (4): 1651-6. PMID 9990079. doi:10.1073/pnas.96.4.1651.
- ↑ J Gen Virol 87 (2006), 3655-3659; DOI 10.1099/vir.0.81843-0 article Recent H5N1 avian Influenza A virus increases rapidly in virulence to mice after a single passage in mice says "To prepare the original virus stock for this study, virus was propagated once in the allantoic cavity of embryonated eggs at 37 °C for 1–2 days and then stored at –80 °C until use."
- ↑ Suarez, D; Spackman E, Senne D, Bulaga L, Welsch A, Froberg K (2003). «The effect of various disinfectants on detection of avian influenza virus by real time RT-PCR». Avian Dis 47 (3 Suppl): 1091-5. PMID 14575118.
- ↑ Center for Infectious Disease Research & Policy (CIDRAP) (28 de agosto de 2008). «Avian Influenza (Bird Flu): Implications for Human Disease». Academic Health Center - Universidad de Minnesota (en inglés). Consultado el 1, 10
|fechaacceso=y|Añoacceso=redundantes (ayuda). - ↑ Reuters (28 de agosto de 2008). «Flu viruses 'can live for decades' on ice». The New Zealand Herald (en inglés). Consultado el 1, 10
|fechaacceso=y|Añoacceso=redundantes (ayuda). - ↑ World Health Organization (WHO) (febrero de 2006). «Avian influenza (" bird flu") - Fact sheet» (en inglés). Consultado el 1, 10
|fechaacceso=y|Añoacceso=redundantes (ayuda). - ↑ World Health Organization (WHO) (19 de agosto de 2005). «WHO position paper: influenza vaccines». Weekly epidemiological record, Vol. 80, 33, pp. 277–288 (en inglés). Consultado el 1, 10
|fechaacceso=y|Añoacceso=redundantes (ayuda). - ↑ Villegas, P (1998). «Viral diseases of the respiratory system». Poult Sci 77 (8): 1143-5. PMID 9706079.
- ↑ Horwood, F; Macfarlane J (2002). «Pneumococcal and influenza vaccination: current situation and future prospects». Thorax. 57 Suppl 2: II24-II30. PMID 12364707.
- ↑ Martin, P; Martin-Granel E (Jun de 2006). «2,500-year evolution of the term epidemic». Emerg Infect Dis 12 (6). PMID 16707055.
- ↑ Hippocrates; Adams, Francis (transl.) (400 BCE). «Of the Epidemics». Consultado el 18 de octubre de 2006.
- ↑ a b c Potter, CW (Oct de 2006). «A History of Influenza». J Appl Microbiol. 91 (4): 572-579. PMID 11576290. doi:10.1046/j.1365-2672.2001.01492.x.
- ↑ a b Patterson, KD; Pyle GF (Spring de 1991). «The geography and mortality of the 1918 influenza pandemic». Bull Hist Med. 65 (1): 4-21. PMID 2021692.
- ↑ a b c d e Knobler S, Mack A, Mahmoud A, Lemon S (ed.). «1: The Story of Influenza». The Threat of Pandemic Influenza: Are We Ready? Workshop Summary (2005). Washington, D.C.: The National Academies Press. pp. 60-61.
- ↑ a b c Taubenberger, J; Reid A, Janczewski T, Fanning T (Dec 29 de 2001). «Integrating historical, clinical and molecular genetic data in order to explain the origin and virulence of the 1918 Spanish influenza virus». Philos Trans R Soc Lond B Biol Sci 356 (1416): 1829-39. PMID 11779381. doi:10.1098/rstb.2001.1020.
- ↑ Simonsen, L; Clarke M, Schonberger L, Arden N, Cox N, Fukuda K (Jul de 1998). «Pandemic versus epidemic influenza mortality: a pattern of changing age distribution». J Infect Dis 178 (1): 53-60. PMID 9652423.
- ↑ a b c d e f Hilleman, M (Aug 19 de 2002). «Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control». Vaccine 20 (25–26): 3068-87. PMID 12163258. doi:10.1016/S0264-410X(02)00254-2.
- ↑ Shimizu, K (Oct de 1997). «History of influenza epidemics and discovery of influenza virus». Nippon Rinsho 55 (10): 2505-201. PMID 9360364.
- ↑ Smith, W; Andrewes CH, Laidlaw PP (1933). «A virus obtained from influenza patients». Lancet 2: 66-68. doi:10.1016/S0140-6736(00)78541-2.
- ↑ Sir Frank Macfarlane Burnet: Biography The Nobel Foundation. Accessed 22 Oct 06
- ↑ Kendall, H (2006). «Vaccine Innovation: Lessons from World War II». Journal of Public Health Policy 27 (1): 38-57. doi:10.1057/palgrave.jphp.3200064.
- ↑ Kawaoka Y (editor). (2006). Influenza Virology: Current Topics. Caister Academic Press. ISBN 978-1-904455-06-6.
- ↑ a b c d e f g Harrison Principios de Medicina Interna 16a edición (2006). «Influenza o gripe». Harrison online en español. McGraw-Hill. Consultado el 13 de septiembre de 2008.
- ↑ a b c «Lista de especies del Género Influenzavirus A». Base de datos del ICTV. Consultado el 25 de septiembre de 2008.
- ↑ Klenk et al (2008). «Avian Influenza: Molecular Mechanisms of Pathogenesis and Host Range». Animal Viruses: Molecular Biology. Caister Academic Press. ISBN 978-1-904455-22-6.
- ↑ a b c Hay, A; Gregory V, Douglas A, Lin Y (Dec 29 de 2001). «The evolution of human influenza viruses». Philos Trans R Soc Lond B Biol Sci 356 (1416): 1861-70. PMID 11779385. doi:10.1098/rstb.2001.0999.
- ↑ Fouchier, R; Schneeberger P, Rozendaal F, Broekman J, Kemink S, Munster V, Kuiken T, Rimmelzwaan G, Schutten M, Van Doornum G, Koch G, Bosman A, Koopmans M, Osterhaus A (2004). «Avian influenza A virus (H7N7) associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome». Proc Natl Acad Sci U S a 101 (5): 1356-61. PMID 14745020. doi:10.1073/pnas.0308352100.
- ↑ Osterhaus, A; Rimmelzwaan G, Martina B, Bestebroer T, Fouchier R (2000). «Influenza B virus in seals». Science 288 (5468): 1051-3. PMID 10807575. doi:10.1126/science.288.5468.1051.
- ↑ Nobusawa, E; Sato K (Apr de 2006). «Comparison of the mutation rates of human influenza A and B viruses». J Virol 80 (7): 3675-8. PMID 16537638. doi:10.1128/JVI.80.7.3675-3678.2006.
- ↑ a b c d R, Webster; Bean W, Gorman O, Chambers T, Kawaoka Y (1992). «Evolution and ecology of influenza A viruses». Microbiol Rev 56 (1): 152-79. PMID 1579108.
- ↑ Zambon, M (Nov de 1999). «Epidemiology and pathogenesis of influenza». J Antimicrob Chemother. 44 Suppl B: 3-9. PMID 10877456. doi:10.1093/jac/44.suppl_2.3.
- ↑ Matsuzaki, Y; Sugawara K, Mizuta K, Tsuchiya E, Muraki Y, Hongo S, Suzuki H, Nakamura K (2002). «Antigenic and genetic characterization of influenza C viruses which caused two outbreaks in Yamagata City, Japan, in 1996 and 1998». J Clin Microbiol 40 (2): 422-9. PMID 11825952. doi:10.1128/JCM.40.2.422-429.2002.
- ↑ Matsuzaki, Y; Katsushima N, Nagai Y, Shoji M, Itagaki T, Sakamoto M, Kitaoka S, Mizuta K, Nishimura H (1 de mayo de 2006). «Clinical features of influenza C virus infection in children». J Infect Dis 193 (9): 1229-35. PMID 16586359. doi:10.1086/502973.
- ↑ Katagiri, S; Ohizumi A, Homma M (Jul de 1983). «An outbreak of type C influenza in a children's home». J Infect Dis 148 (1): 51-6. PMID 6309999.
- ↑ International Committee on Taxonomy of Viruses descriptions of: Orthomyxoviridae, Influenzavirus B and Influenzavirus C
- ↑ International Committee on Taxonomy of Viruses. «The Universal Virus Database, version 4: Influenza A».
- ↑ Ghedin, E; Sengamalay N, Shumway M, Zaborsky J, Feldblyum T, Subbu V, Spiro D, Sitz J, Koo H, Bolotov P, Dernovoy D, Tatusova T, Bao Y, St George K, Taylor J, Lipman D, Fraser C, Taubenberger J, Salzberg S (20 de octubre de 2005). «Large-scale sequencing of human influenza reveals the dynamic nature of viral genome evolution». Nature 437 (7062): 1162-6. PMID 16208317. doi:10.1038/nature04239.
- ↑ Suzuki, Y (2005). «Sialobiology of influenza: molecular mechanism of host range variation of influenza viruses». Biol Pharm Bull 28 (3): 399-408. PMID 15744059. doi:10.1248/bpb.28.399.
- ↑ Wilson, J; von Itzstein M (Jul de 2003). «Recent strategies in the search for new anti-influenza therapies». Curr Drug Targets 4 (5): 389-408. PMID 12816348. doi:10.2174/1389450033491019.
- ↑ a b Wagner, R; Matrosovich M, Klenk H (May–Jun de 2002). «Functional balance between haemagglutinin and neuraminidase in influenza virus infections». Rev Med Virol 12 (3): 159-66. PMID 11987141. doi:10.1002/rmv.352.
- ↑ Lakadamyali, M; Rust M, Babcock H, Zhuang X (Aug 5 de 2003). «Visualizing infection of individual influenza viruses». Proc Natl Acad Sci U S a 100 (16): 9280-5. PMID 12883000. doi:10.1073/pnas.0832269100.
- ↑ Cros, J; Palese P (Sep de 2003). «Trafficking of viral genomic RNA into and out of the nucleus: influenza, Thogoto and Borna disease viruses». Virus Res 95 (1–2): 3-12. PMID 12921991. doi:10.1016/S0168-1702(03)00159-X.
- ↑ Kash, J; Goodman A, Korth M, Katze M (Jul de 2006). «Hijacking of the host-cell response and translational control during influenza virus infection». Virus Res 119 (1): 111-20. PMID 16630668. doi:10.1016/j.virusres.2005.10.013.
- ↑ Nayak, D; Hui E, Barman S (Dec de 2004). «Assembly and budding of influenza virus». Virus Res 106 (2): 147-65. PMID 15567494. doi:10.1016/j.virusres.2004.08.012.
- ↑ Drake, J (1 de mayo de 1993). «Rates of spontaneous mutation among RNA viruses». Proc Natl Acad Sci USA 90 (9): 4171-5. PMID 8387212. doi:10.1073/pnas.90.9.4171.
- ↑ Schmitz N, Kurrer M, Bachmann M, Kopf M (2005). «Interleukin-1 is responsible for acute lung immunopathology but increases survival of respiratory influenza virus infection». J Virol 79 (10): 6441-8. PMID 15858027. doi:10.1128/JVI.79.10.6441-6448.2005.
- ↑ Winther B, Gwaltney J, Mygind N, Hendley J (1998). «Viral-induced rhinitis». Am J Rhinol 12 (1): 17-20. PMID 9513654. doi:10.2500/105065898782102954.
- ↑ a b Recommended composition of influenza virus vaccines for use in the 2006–2007 influenza season WHO report 2006-02-14. Accessed 19 October 2006.
- ↑ a b c GUTIERREZ, Eliana Battaggia, LI, Ho Yeh, SANTOS, Ana Catarina De Seixas et al. Effectiveness of influenza vaccination in elderly outpatients in São Paulo city, Brazil. Rev. Inst. Med. trop. S. Paulo [online]. 2001, vol. 43, no. 6 [citado el 10 de septiembre, 2008], pp. 317-320. Disponible en la World Wide Web: [1]. ISSN 0036-4665. doi: 10.1590/S0036-46652001000600003.
- ↑ Weather and the Flu Season NPR Day to Day, December 17 2003. Accessed, 19 October 2006
- ↑ Lowen AC, Mubareka S, Steel J, Palese P (2007). «Influenza virus transmission is dependent on relative humidity and temperature». PLoS Pathog. 3 (10): 1470-6. PMID 17953482. doi:10.1371/journal.ppat.0030151.
- ↑ Shek LP, Lee BW. "Epidemiology and seasonality of respiratory tract virus infections in the tropics." Paediatr Respir Rev. 2003 Jun;4(2):105–11. PMID 12758047
- ↑ Dushoff J, Plotkin JB, Levin SA, Earn DJ. "Dynamical resonance can account for seasonality of influenza epidemics." Proc Natl Acad Sci U S A. 30 November2004;101(48):16915–6. PMID 15557003
- ↑ Angelo SJ, Marshall PS, Chrissoheris MP, Chaves AM. "Clinical characteristics associated with poor outcome in patients acutely infected with Influenza A." Conn Med. 2004 Apr;68(4):199–205. PMID 15095826
- ↑ Murin S, Bilello K (2005). «Respiratory tract infections: another reason not to smoke». Cleve Clin J Med 72 (10): 916-20. PMID 16231688.
- ↑ Kerr AA, McQuillin J, Downham MA, Gardner PS (1975). «Gastric 'flu influenza B causing abdominal symptons in children». Lancet 1 (7902): 291-5. PMID 46444. doi:10.1016/S0140-6736(75)91205-2.
- ↑ a b c d Call S, Vollenweider M, Hornung C, Simel D, McKinney W (2005). «Does this patient have influenza?». JAMA 293 (8): 987-97. PMID 15728170. doi:10.1001/jama.293.8.987. Error en la cita: Etiqueta
<ref>no válida; el nombre «pmid15728170» está definido varias veces con contenidos diferentes - ↑ Monto A, Gravenstein S, Elliott M, Colopy M, Schweinle J (2000). «Clinical signs and symptoms predicting influenza infection». Arch Intern Med 160 (21): 3243-7. PMID 11088084. doi:10.1001/archinte.160.21.3243.
- ↑ Centers for Disease Control and Prevention. Weekly Report: Influenza Summary Update. Accessed January 1, 2007.
- ↑ Smith K, Roberts M (2002). «Cost-effectiveness of newer treatment strategies for influenza». Am J Med 113 (4): 300-7. PMID 12361816. doi:10.1016/S0002-9343(02)01222-6.
- ↑ a b c d Rothberg M, Bellantonio S, Rose D (2003). «Management of influenza in adults older than 65 years of age: cost-effectiveness of rapid testing and antiviral therapy». Ann Intern Med 139 (5 Pt 1): 321-9. PMID 12965940.
- ↑ Centers for Disease Control and Prevention. Lab Diagnosis of Influenza. Accessed on January 1, 2007
- ↑ Glasgow, J; Middleton B (2001). «Reye syndrome — insights on causation and prognosis». Arch Dis Child 85 (5): 351-3. PMID 11668090. doi:10.1136/adc.85.5.351.
- ↑ Centers for Disease Control and Prevention. CDC Recommends against the Use of Amantadine and Rimantadine for the Treatment or Prophylaxis of Influenza in the United States during the 2005–06 Influenza Season. January 14, 2006. Consultada el 1 de enero de 2007
- ↑ a b c d CALVO A., Mario. Otra nueva mala noticia en gripe aviar Oseltamivar resistance during treatment of Influenza A (H5N1) infection Jong MD, Thanh TT, Khanh TH, Hien VM et al. NEJM 353; 25: 2667-72. Rev. chil. infectol. [online]. Mar. 2006, vol.23, no.1 [citado 10 septiembre 2008], p.84-85. Disponible en la World Wide Web: [2]. ISSN 0716-1018.
- ↑ Moscona, A (2005). «Neuraminidase inhibitors for influenza». N Engl J Med 353 (13): 1363-73. PMID 16192481. doi:10.1056/NEJMra050740.
- ↑ a b Stephenson, I; Nicholson K (1999). «Chemotherapeutic control of influenza». J Antimicrob Chemother 44 (1): 6-10. PMID 10459804. doi:10.1093/jac/44.1.6.
- ↑ Jefferson, T; Demicheli V, Di Pietrantonj C, Jones M, Rivetti D (2006). «Neuraminidase inhibitors for preventing and treating influenza in healthy adults». Cochrane Database Syst Rev 3: CD001265. PMID 16855962. doi:10.1002/14651858.CD001265.pub2.
- ↑ Webster, Robert G. (2006). «H5N1 Influenza — Continuing Evolution and Spread». N Engl J Med 355 (21): 2174-77. PMID 16192481. doi:10.1056/NEJMp068205.
- ↑ «High levels of adamantane resistance among influenza A (H3N2) viruses and interim guidelines for use of antiviral agents — United States, 2005–06 influenza season». MMWR Morb Mortal Wkly Rep 55 (2): 44-6. 2006. PMID 16424859.
- ↑ Peter M. Sandman and Jody Lanard "Bird Flu: Communicating the Risk" 2005 Perspectives in Health Magazine Vol. 10 issue 2.
- ↑ a b Key Facts about Influenza (Flu) Vaccine CDC publication. Published October 17, 2006. Accessed 18 Oct 2006.
- ↑ a b MANCINI, Dalva A. Portari, NASCIMENTO, Elvira M. Mendes do, TAVARES, Valéria Rosa et al. Vacina inativada contra gripe trivalente: estudo comparativo da resposta imunitária pelos métodos de inibição de hemaglutinação e da hemólise radial simples. Rev. Saúde Pública [online]. 1985, vol. 19, no. 5 [citado 2008-09-10], pp. 438-443. Disponível em: [3]. ISSN 0034-8910. doi: 10.1590/S0034-89101985000500007.
- ↑ a b MORALES, A., ARIAS SALAZAR, J., SALAZAR, Y. et al. A randomized controlled trial comparing split and subunit influenza vaccines in adults in Colombia. Medicina (B. Aires). [online]. mayo/jun. 2003, vol.63, no.3 [citado 10 Septiembre 2008], p.197-204. Disponible en la World Wide Web: [4]. ISSN 0025-7680.
- ↑ Capua, I; Alexander D (2006). «The challenge of avian influenza to the veterinary community». Avian Pathol 35 (3): 189-205. PMID 16753610. doi:10.1080/03079450600717174.
- ↑ Holmes, E; Ghedin E, Miller N, Taylor J, Bao Y, St George K, Grenfell B, Salzberg S, Fraser C, Lipman D, Taubenberger J (2005). «Whole-genome analysis of human influenza A virus reveals multiple persistent lineages and reassortment among recent H3N2 viruses». PLoS Biol 3 (9): e300. PMID 16026181. doi:10.1371/journal.pbio.0030300.
- ↑ a b Prevention and Control of Influenza: Recommendations of the Advisory Committee on Immunization Practices (ACIP) CDC report (MMWR 2006 Jul 28;55(RR10):1–42) accessed 19 Oct 2006.
- ↑ Questions & Answers: Flu Shot CDC publication updated Jul 24, 2006. Accessed 19 Oct 06.
- ↑ a b Carrat F, Luong J, Lao H, Sallé A, Lajaunie C, Wackernagel H (2006). «A 'small-world-like' model for comparing interventions aimed at preventing and controlling influenza pandemics». BMC Med 4: 26. PMID 17059593. doi:10.1186/1741-7015-4-26.
- ↑ Mitamura K, Sugaya N (2006). «[Diagnosis and Treatment of influenza—clinical investigation on viral shedding in children with influenza]». Uirusu 56 (1): 109-16. PMID 17038819. doi:10.2222/jsv.56.109.
- ↑ Hota B (2004). «Contamination, disinfection, and cross-colonization: are hospital surfaces reservoirs for nosocomial infection?». Clin Infect Dis 39 (8): 1182-9. PMID 15486843. doi:10.1086/424667.
- ↑ a b McDonnell G, Russell A (1999). «Antiseptics and disinfectants: activity, action, and resistance». Clin Microbiol Rev 12 (1): 147-79. PMID 9880479.
- ↑ Hatchett RJ, Mecher CE, Lipsitch M (2007). «Public health interventions and epidemic intensity during the 1918 influenza pandemic». Proc Natl Acad Sci U S A. 104 (18): 7582-7587. PMID 17416679. doi:10.1073/pnas.0610941104.
- ↑ Bootsma MC, Ferguson NM (2007). «The effect of public health measures on the 1918 influenza pandemic in U.S. cities». Proc Natl Acad Sci U S A. 104 (18): 7588-7593. PMID 17416677. doi:10.1073/pnas.0611071104.
- ↑ Influenza A Virus Genome Project at The Institute of Genomic Research. Accessed 19 Oct 06
- ↑ Subbarao K, Katz J. «Influenza vaccines generated by reverse genetics». Curr Top Microbiol Immunol 283: 313-42. PMID 15298174.
- ↑ Bardiya N, Bae J (2005). «Influenza vaccines: recent advances in production technologies». Appl Microbiol Biotechnol 67 (3): 299-305. PMID 15660212. doi:10.1007/s00253-004-1874-1.
- ↑ Neirynck S, Deroo T, Saelens X, Vanlandschoot P, Jou WM, Fiers W (October de 1999). «A universal influenza A vaccine based on the extracellular domain of the M2 protein». Nat. Med. 5 (10): 1157-63. PMID 10502819. doi:10.1038/13484.
- ↑ Fiers W, Neirynck S, Deroo T, Saelens X, Jou WM (December de 2001). «Soluble recombinant influenza vaccines». Philos. Trans. R. Soc. Lond., B, Biol. Sci. 356 (1416): 1961-3. PMC 1088575. PMID 11779398. doi:10.1098/rstb.2001.0980.
- ↑ Fiers W, De Filette M, Birkett A, Neirynck S, Min Jou W (July de 2004). «A "universal" human influenza A vaccine». Virus Res. 103 (1-2): 173-6. PMID 15163506. doi:10.1016/j.virusres.2004.02.030.
- ↑ Gorman O, Bean W, Kawaoka Y, Webster R (1990). «Evolution of the nucleoprotein gene of influenza A virus». J Virol 64 (4): 1487-97. PMID 2319644.
- ↑ Hinshaw V, Bean W, Webster R, Rehg J, Fiorelli P, Early G, Geraci J, St Aubin D (1984). «Are seals frequently infected with avian influenza viruses?». J Virol 51 (3): 863-5. PMID 6471169.
- ↑ Elbers A, Koch G, Bouma A (2005). «Performance of clinical signs in poultry for the detection of outbreaks during the avian influenza A (H7N7) epidemic in The Netherlands in 2003». Avian Pathol 34 (3): 181-7. PMID 16191700. doi:10.1080/03079450500096497.
- ↑ Capua I, Mutinelli F. "Low pathogenicity (LPAI) and highly pathogenic (HPAI) avian influenza in turkeys and chicken." In: Capua I, Mutinelli F. (eds.), A Colour Atlas and Text on Avian Influenza, Papi Editore, Bologna, 2001, pp. 13–20
- ↑ Bano S, Naeem K, Malik S (2003). «Evaluation of pathogenic potential of avian influenza virus serotype H9N2 in chickens». Avian Dis 47 (3 Suppl): 817-22. PMID 14575070.
- ↑ Swayne D, Suarez D (2000). «Highly pathogenic avian influenza». Rev Sci Tech 19 (2): 463-82. PMID 10935274.
- ↑ Li K, Guan Y, Wang J, Smith G, Xu K, Duan L, Rahardjo A, Puthavathana P, Buranathai C, Nguyen T, Estoepangestie A, Chaisingh A, Auewarakul P, Long H, Hanh N, Webby R, Poon L, Chen H, Shortridge K, Yuen K, Webster R, Peiris J (2004). «Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia». Nature 430 (6996): 209-13. PMID 15241415. doi:10.1038/nature02746.
- ↑ Li KS, Guan Y, Wang J, Smith GJ, Xu KM, Duan L, Rahardjo AP, Puthavathana P, Buranathai C, Nguyen TD, Estoepangestie AT, Chaisingh A, Auewarakul P, Long HT, Hanh NT, Webby RJ, Poon LL, Chen H, Shortridge KF, Yuen KY, Webster RG, Peiris JS. "The Threat of Pandemic Influenza: Are We Ready?" Workshop Summary The National Academies Press (2005) "Today's Pandemic Threat: Genesis of a Highly Pathogenic and Potentially Pandemic H5N1 Influenza Virus in Eastern Asia", pages 116–130
- ↑ Liu J (2006). «Avian influenza—a pandemic waiting to happen?». J Microbiol Immunol Infect 39 (1): 4-10. PMID 16440117.
- ↑ a b Rosenthal, E. and Bradsher, K. Is Business Ready for a Flu Pandemic? The New York Times 16-03-2006 Accessed 17-04-2006
- ↑ Brainerd, E. and M. Siegler (2003), “The Economic Effects of the 1918 Influenza Epidemic”, CEPR Discussion Paper, no. 3791.
- ↑ Poland G (2006). «Vaccines against avian influenza—a race against time». N Engl J Med 354 (13): 1411-3. PMID 16571885. doi:10.1056/NEJMe068047.
- ↑ Donor Nations Pledge $1.85 Billion to Combat Bird Flu Newswire Accessed 26 Oct 2006.
- ↑ US AID. «Avian Influenza and its Global Implications» (PDF). Consultado el 26 de octubre de 2006.
- ↑ Lye DC, Ang BS, Leo YS (2007). «Review of human infections with avian influenza H5N1 and proposed local clinical management guideline». Ann. Acad. Med. Singap. 36 (4): 285-92. PMID 17483860.
- ↑ Poultry sector suffers despite absence of bird flu UN Office for the Coordination of Humanitarian Affairs. Accessed 26 Oct 2006
- ↑ Nine poultry farmers commit suicide in flu-hit India Reuters. Published on April 12, 2006. Accessed 26 Oct 2006.
- ↑ In the Nile Delta, Bird Flu Preys on Ignorance and Poverty The New York Times. Published on April 13, 2006. Accessed 26 Oct 2006.
Bibliografía
Véase también
- Brote de gripe A (H1N1) de 2009
- Gripe aviar
- Gripe asiática
- Gripe española
- Gripe porcina
- Infección respiratoria alta
- Patologías del aparato respiratorio
- Síndrome respiratorio agudo severo
Enlaces externos =
 Wikimedia Commons alberga una categoría multimedia sobre Gripe.
Wikimedia Commons alberga una categoría multimedia sobre Gripe.- En MedlinePlus hay más información sobre Gripe
- ElObservador.rctv.net (expertos señalan que es posible desarrollar nuevos medicamentos para combatir virus de la influenza).
- Influenza-A.es (información en español sobre la Gripe-A).
- Medicine.PLosJournals.org (A Systematic Analytic Approach to Pandemic Influenza Preparedness Planning; en inglés).
- Phil. CDC.gov (imágenes del CDC relacionadas con la gripe).
- Información sobre la gripe en el CDC
 Wikcionario tiene definiciones y otra información sobre gripe.
Wikcionario tiene definiciones y otra información sobre gripe.
