Diferencia entre revisiones de «Enlace iónico»
m Revertidos los cambios de 190.164.165.172 a la última edición de Diegusjaimes |
|||
| Línea 79: | Línea 79: | ||
== Referencias == |
== Referencias == |
||
<references/> |
<references/> |
||
== Véase también == |
== Véase también == |
||
Revisión del 00:17 29 jul 2009
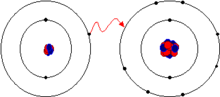
En química, el enlace iónico es la unión que resulta de la presencia de fuerzas de atracción electrostática entre los iones de distinto signo. Se da cuando uno de los átomos capta electrones del otro.
El metal dona uno o más electrones formando aniones que son iones con carga negativa o cationes con una carga positiva y configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un enlace.
Los compuestos iónicos forman redes cristalinas constituidas por iones de carga opuesta unidos por fuerzas electrostáticas. Este tipo de atracción determina las propiedades observadas. Si la atracción electrostática es fuerte, se forman sólidos cristalinos de elevado punto de fusión e insolubles en agua; si la atracción es menor, como en el caso del NaCl, el punto de fusión también es menor y, en general, son solubles en agua e insolubles en líquidos apolares como el benceno.[1]
Definición
Se denomina enlace iónico al enlace químico de dos o más átomos cuando éstos tienen una diferencia de electronegatividad igual ó mayor a 1.6. En una unión de dos átomos por enlace iónico, un electrón abandona el átomo menos electronegativo y pasa a formar parte de la nube electrónica del más electronegativo. El cloruro de sodio (la sal común) es un ejemplo de enlace iónico: en él se combinan sodio y cloro, perdiendo el primero un electrón que es capturado por el segundo:
- Na Cl → Na + Cl-
De esta manera se forman dos iones de carga contraria: un catión (de carga positiva) y un anión (de carga negativa). La diferencia entre las cargas de los iones provoca entonces una fuerza de interacción electromagnética entre los átomos que los mantiene unidos. El enlace iónico es la unión en la que los elementos involucrados aceptarán o perderán electrones.
En la solución, los enlaces iónicos pueden romperse y se considera entonces que los iones están disociados. Es por eso que una solución fisiológica de cloruro de sodio y agua se marca como "Na+ + Cl-" mientras que los cristales de cloruro de sodio se marcan "Na+Cl-" o simplemente "NaCl".
Características

Algunas características de los compuestos formados por este tipo de enlace son:
- Son sólidos de estructura cristalina en el sistema cúbico.
- Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
- Altos puntos de fusión y ebullición.
- Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
- Son solubles en disolventes polares y aun así su solubilidad es muy baja.
- Una vez fundidos o en solución acuosa, sí conducen la electricidad.
- En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
Clasificación
Los iones se clasifican en dos tipos:
a) Anión: Es un ión con carga negativa, lo que significa que los átomos que lo conforman tienen un exceso de electrones. Comúnmente los aniones están formados por no metales, aunque hay ciertos aniones formados por metales y no metales. Los aniones más conocidos son (el número entre paréntesis indica la carga):
- F(-) fluoruro
- Cl(-) cloruro
- Br(-) bromuro
- I(-) yoduro
- S(2-) sulfuro
- SO4(2-) sulfato
- NO3(-) nitrato
- PO4(3-) fosfato
- ClO(-) hipoclorito
- ClO2(-) clorito
- ClO3(-) clorato
- ClO4(-) perclorato
- CO3(2-) carbonato
- BO3(3-) borato
- MnO4(-) permanganato
- CrO4(2-) cromato
- Cr2O7(2-) dicromato
b) Catión: Al contrario que los aniones, los cationes son especies químicas con déficit de electrones, lo que les otorga una carga eléctrica positiva. Los más comunes son formados a partir de metales, pero hay ciertos cationes formados con no metales.
- Na(+) sodio
- K(+) potasio
- Ca(2+) calcio
- Ba(2+) bario
- Mg(2+) magnesio
- Al(3+) aluminio
- Pb(2+) plomo(II) ó plumboso
- Zn(2+) zinc (ó cinc)
- Fe(2+) hierro(II) ó ferroso
- Fe(3+) hierro(III) ó férrico
- Cu(+) cobre(I) ó cuproso (aunque en verdad, este ión es Cu2(2+))
- Cu(2+) cobre(II) ó cúprico
- Hg(+) mercurio(I) ó mercurioso (aunque en verdad, este ión es Hg2(2+))
- Hg(2+) mercurio(II) ó mercúrico
- Ag(+) plata
- Cr(3+) cromo(III)
- Mn(2+) manganeso(II)
- Co(2+) cobalto(II) ó cobaltoso
- Co(3+) cobalto(III) ó cobáltico
- Ni(2+) níquel(II) ó niqueloso
- Ni(3+) níquel(III) ó niquélico
- NH4(+) amonio
- NO2(+) nitronio
- H3O(+) hidronio
Referencias
- ↑ Jimeno, et. al. 1999. Biologia II. Santillana, Barcelona. ISBN 84-7911-813-X
