Diferencia entre revisiones de «Cáncer de pulmón»
m Revertidos los cambios de 87.218.198.77 a la última edición de MastiBot |
|||
| Línea 130: | Línea 130: | ||
[[Archivo:Lung cancer US distribution.gif|right|thumb|300px|Distribución del cáncer de pulmón en los [[Estados Unidos]], donde se encuentra la mayor [[mortalidad]] asociada a cáncer de pulmón en el mundo.]] |
[[Archivo:Lung cancer US distribution.gif|right|thumb|300px|Distribución del cáncer de pulmón en los [[Estados Unidos]], donde se encuentra la mayor [[mortalidad]] asociada a cáncer de pulmón en el mundo.]] |
||
El cáncer de pulmón es una [[neoplasia]] muy agresiva y mortal, la mayoría de los pacientes mueren antes del primer año después del diagnóstico. Es el cáncer más frecuente en varones de más de 35 países, sobre todo países desarrollados o industrializados, incluida España, siendo la primera causa de muerte por cáncer tanto en hombres como en mujeres. Más personas mueren de cáncer del pulmón que de [[cáncer de colon]], [[cáncer de mama|de mama]] y de [[cáncer de próstata|próstata]] juntos. Representa el 12,5% de todos los tumores malignos en [[España]]. La mayor mortalidad mundial entre mujeres está en los [[Estados Unidos]]. |
El cáncer de pulmón es una [[neoplasia]] muy agresiva y mortal, la mayoría de los pacientes mueren antes del primer año después del diagnóstico. Es el cáncer más frecuente en varones de más de 35 países, sobre todo países desarrollados o industrializados, incluida España, siendo la primera causa de muerte por cáncer tanto en hombres como en mujeres. Más personas mueren de cáncer del pulmón que de [[cáncer de colon]], [[cáncer de mama|de mama]] y de [[cáncer de próstata|próstata]] juntos. Representa el 12,5% de todos los tumores malignos en [[España]]. La mayor mortalidad mundial entre mujeres está en los [[Estados Unidos]]. |
||
=== Aumento de la incidencia === |
=== Aumento de la incidencia === |
||
Revisión del 23:27 29 jul 2009
| Cáncer de pulmón | ||
|---|---|---|
 Corte torácico en un estudio tomográfico mostrando la localización de un tumor de cancer pulmonar | ||
| Especialidad |
oncología neumología | |
El cáncer de pulmón es la enfermedad resultante del crecimiento anormal de células en el tejido pulmonar. Proveniente de células epiteliales, este crecimiento generalmente maligno, puede derivar en metástasis e infiltración a otros tejidos del cuerpo.
Los síntomas más frecuentes suelen ser dificultad respiratoria, tos —incluyendo tos sanguinolenta— y pérdida de peso,[1] así como también dolor torácico, ronquera e hinchazón en cuello y cara.[2]
El cáncer de pulmón es clasificado en dos tipos principales, en función del tamaño y apariencia de la células malignas: el cáncer pulmonar de células pequeñas (microcítico) y el de células no pequeñas (no microcítico). Otros tipos son mixto y metastásico.[3] Esta distinción condiciona el tratamiento y así, mientras el primero por lo general, es tratado con quimioterapia y radiación, el segundo tiende a serlo además, mediante cirugía,[4] láser y terapia fotodinámica.[5] La causa más común de cáncer de pulmón es el tabaquismo,[6] siendo el 95 por ciento de pacientes con cáncer de pulmón fumadores y ex fumadores.[7] En las personas no-fumadoras, la aparición del cáncer de pulmón es resultado de una combinación de factores genéticos,[8][9] gas radón,[10] asbesto,[11] y contaminación atmosférica,[12][13][14] incluyendo humo secundario (fumadores pasivos).[15][16] El diagnóstico temprano del cancer de pulmón es el principal condicionante para el éxito en su tratamiento. En estadíos tempranos, el cancer de pulmón puede, en alrededor el 20% de los casos,[17] ser tratado mediante resección quirúrgica con éxito de curación.[18] Sin embargo, debido a su virulencia y a la dificultad para su detección precoz, en la mayoría de los casos de diagnóstico donde ya ocurre metástasis, el cancer de pulmón presenta junto con el cáncer de hígado, páncreas y esófago, los pronosticos peores, siendo todavía una enfermedad incurable, con una esperanza de vida promedio de aproximadamente 8 meses.[19] En España, la supervivencia ha ido mejorado desde el 6% de supervivencia a 5 años para casos diagnosticados entre 1980 y 1985, al 12,4% para los diagnosticados entre 1990 y 1994.[20]
El cáncer de pulmón es una de las enfermedades más graves y uno de los cánceres con mayor incidencia en el ser humano, responsable de los mayores índices de mortalidad oncológica a escala mundial. Es la primera causa de mortalidad por cáncer en el varón y la tercera, después del de colon y mama, en la mujer,[21][22] causando más de un millón de muertes cada año en el Mundo.[23] En el Reino Unido (2004) y en los Estados Unidos (2006) representa la primera causa de muerte por cáncer en mujeres y hombres. En España son diagnosticados anualmente unos 20.000 casos, lo que representa el 18,4% de los tumores entre los hombres (18.000 casos) y el 3,2% entre las mujeres (2.000 casos).[20]
Clasificación
| Forma histológica | Frecuencia (%) |
|---|---|
| Cáncer pulmonar de células no-pequeñas | 80,4 |
| Cáncer de pulmón de células pequeñas | 16,8 |
| Carcinoide[25] | 0,8 |
| Sarcoma[26] | 0,1 |
| Cáncer de pulmón no especificado | 1,9 |
La gran mayoría de los tipos de cáncer de pulmón son carcinomas, es decir, tumores malignos que nacen de células epiteliales. Hay dos formas adicionales de cáncer de pulmón, categorizados por el tamaño y apariencia de la células malignas vistas histopatológicamente bajo un microscopio: los tumores de células no-pequeñas (80,4%) y los de células pequeñas (16,8%).[24] Esta clasificación está basada en criterios histológicos y tiene importantes implicaciones para el tratamiento y pronóstico de la enfermedad.
Cáncer pulmonar de células no-pequeñas (NSCLC)
Los carcinomas pulmonares de células no-pequeñas se agrupan por razón de que su pronóstico y tratamiento son muy similares. Existen tres subtipos principales: el carcinoma de células escamosas del pulmón, los adenocarcinomas y el carcinoma de pulmón de células grandes.
| Subtipo histológico | Frecuencia (%) | |
|---|---|---|
| Carcinoma pulmonar de células escamosas | 31.1 | |
| Adenocarcinoma | Adenocarcinoma (no especificado) | 23.2 |
| Carcinoma bronquioloalveolar | 3.0 | |
| Carcinoma adenoescamoso | 1.2 | |
| Adenocarcinoma papilar | 0.7 | |
| Carcinoma mucoepidermoide[27] | 0.1 | |
| Carcinoma adenoide cístico[28] | 0.04 | |
| Otros adenocarcinomas | 1.1 | |
| Carcinoma de células grandes | 10.7 | |
| Carcinoma de células giganes y estrelladas | 0.4 | |
| Otros o no especificados del tipo células no-pequeñas | 8.9 | |
Totalizando cerca de un 31% de todos los carcinomas de pulmón,[24] el carcinoma de células escamosas del pulmón por lo general comienza cerca de un bronquio central. Comunmente se ve necrosis y cavitación en el centro del tumor. Aquellos tumores de células escamosas bien diferenciadas a menudo crecen más lentamente que los otros tipos de cáncer.[4]
Los adenocarcinomas representan un 29,4% de todos los tipos de cáncer de pulmón.[24] Por lo general se originan del tejido pulmonar periférico. La mayoría de los casos de adenocarcinoma de pulmón están asociados al hábito de fumar cigarrillos. Sin embargo, entre aquellos que nunca han fumado en sus vidas, los adenocarcinomas son la forma más frecuente de cáncer de pulmón.[29] Uno de los subtipos de adenocarcinomas, el carcinoma bronquioloalveolar, se ve con más frecuencia entre mujeres que nunca han fumado y generalmente muestra respuestas diferentes al tratamiento de un individuo al otro.[30]
Los carcinomas de células gigantes representan un 10,7% de todas las formas de cáncer de pulmón.[24] Son tumores que crecen con rapidez cercano a la superficie del pulmón.[31] A menudo son células pobremente diferenciadas y tienden a la metastasis con rapidez.[4]
Carcinoma de células pequeñas (SCLC)

El cáncer de pulmón de células pequeñas, también llamado carcinoma de células de avena es mucho menos frecuente. Tiende a aparecer en las vías aéreas de mayor calibre—como en los brónquios primarios y secundarios—y crece rapidamente llegando a formar un gran tamaño.[32] La célula de avena contiene densos gránulos neurosecretores, es decir, vesículas que contienen hormonas neuroendocrinas, que le da una asociación con un síndrome endocrino o paraneoplásico.[33] Aunque es un tipo de cáncer que inicialmente resulta más sensible a la quimioterapia, ultimadamente conlleva un peor pronóstico y con frecuencia presenta metástasis. Los tumores de pulmón de células pequeñas se dividen en una etapa limitada y una etapa avanzada o diseminada. Este tipo de cáncer está igualmente asociado al tabaquismo.[34]
Cáncer metastásico de pulmón
El Doctor Alvaro en su investigaciòn expuso: El pulmón es sitio común para la metástasis de tumores de otras partes del cuerpo. Estos son cánceres identificados por el sitio de origen, de modo que un cáncer de mama en el pulmón sigue siendo un cáncer de mama. A menudo tienen una característica forma redondeada en la radiografía de tórax.[35] Los tumores primarios del pulmón hacen metástasis especialmente en las glándulas suprarrenales, hígado, cerebro, y hueso.[4]
Epidemiología
A nivel mundial, el cáncer de pulmón es la forma más frecuente de cáncer en términos de incidencia y de mortalidad causando cerca de 1.18 millones de muertes cada año, con las tasas más elevadas en países de Europa y Norteamérica.[36] El segmento poblacional más afectado son aquellos mayores de 50 años de edad que tienen una historia personal de tabaquismo. La incidencia de cáncer de pulmón por país tiene una correlación inversa con la exposición a la luz solar o rayos ultravioleta.[37]
Frecuencia
El cáncer de pulmón o carcinoma broncogénico representa el 97% de los tumores pulmonares. De este 97%, el 93% corresponde al cáncer de pulmón primario y el 4% lo forman tumores secundarios o metastásicos. El 2% corresponde al adenoma bronquial y el 1% son tumores benignos. El término broncogénico se aplica a la mayoría de los cánceres de pulmón pero es algo erróneo ya que implica un origen bronquial para todos ellos, a pesar de que los adenocarcinomas, que son periféricos, son más frecuentemente de origen bronquiolar. Actualmente (2004) es el cáncer más frecuente respecto a la incidencia con 1.040.000 de casos nuevos cada año, en todo el mundo.[38] La relación con el tabaquismo es tal que la incidencia de muerte por cáncer de pulmón es 46, 95, 108, 229 y 264 por cada 100 mil habitantes entre los que fuman media caja, media - 1 caja, 1 - 2 cajas, 2 cajas y más de 2 cajas diarias respectivamente.
Mortalidad

El cáncer de pulmón es una neoplasia muy agresiva y mortal, la mayoría de los pacientes mueren antes del primer año después del diagnóstico. Es el cáncer más frecuente en varones de más de 35 países, sobre todo países desarrollados o industrializados, incluida España, siendo la primera causa de muerte por cáncer tanto en hombres como en mujeres. Más personas mueren de cáncer del pulmón que de cáncer de colon, de mama y de próstata juntos. Representa el 12,5% de todos los tumores malignos en España. La mayor mortalidad mundial entre mujeres está en los Estados Unidos.
Aumento de la incidencia
El número de casos ha ido en aumento desde principios del siglo XX, duplicándose cada 15 años. La incidencia ha aumentado cerca de 20 veces entre 1940 y 1970. A principios del siglo XX, se consideraba que la mayor parte de los tumores pulmonares eran metastásicos, y que el cáncer primitivo era raro. El cancer de pulmón es menos común en países en vías de desarrollo,[39] sin embargo, se espera que la incidencia aumente en los siguientes años, notablemente en China[40] y la India.[41]
Género
El cáncer de pulmón es la neoplasia más frecuente en el varón, especialmente en el este de Europa, con tasas cercanas a 70 casos por cada 100,000 de población en los países con más casos y una tasa cercana a 20 en países como Colombia, Suiza y países que reportan las incidencias más bajas.[42] La tasa entre mujeres es aproximadamente la mitad de la de los hombres, con tasas cercanas a 30 por cada 100,000 de población en los países con más casos y una tasa cercana a 20 en países como Colombia, Suiza y otros países que reportan las incidencias más bajas.[42] India tiene una tasa de 12.1 y 3.8 por 100,000 entre hombres y mujeres respectivamente.[42] En la mujer sigue teniendo una menor incidencia, pero ya se ha situado en algunos países en segundo lugar después del cáncer de mama, incluso en primer lugar.[43] Aunque la tasa de mortalidad entre los hombres de países occidentales está en declinación, la tasa de mortalidad de mujeres por cáncer de pulmón está aumentando, debido al incremento en el número de nuevos fumadores en este grupo.[38]
Edad
Afecta sobre todo a personas entre los 60 y los 65 años. Menos del 15% de los casos acontecen en pacientes menores de 30 años de edad.[38] La edad promedio de las personas a las que se les detecta cáncer del pulmón es 60 años.[38] Por razón de que en muchos países se ha observado un aumento en la cantidad de fumadores jóvenes, por lo que se observarán cambios en la mortalidad por edades en el siguiente siglo.[38]
Etiología o causa del cáncer de pulmón
Las principales causas del cáncer de pulmón, así como del cáncer en general, incluyen carcinógenos tales como el humo del cigarrillo, radiación ionizante e infecciones virales. La exposición a estos agentes causa cambios acumulativos sobre el ADN de las células, acumulandose progresivamente alteraciones genéticas que transforman el epitelio que reviste los bronquios del pulmón.[44] A medida que hay daño más extenso, se desarrolla un cáncer.[4]
Tabaco
La demostración de una relación positiva entre el tabaco y la aparición del cáncer de pulmón está bien establecida,[44] hasta el punto que casi se considera más que un factor de riesgo un factor causal y es indiscutible por los datos acumulados de:
Demostración estadística

- Frecuencia: el 80-90% de los cánceres de pulmón se dan en fumadores,[45] o que hayan dejado de fumar recientemente,[44] pero no hay evidencia de que se asocie a una variedad histológica concreta, aunque tiende a relacionarse más con el carcinoma epidermoide y con el cáncer de células pequeñas.[46] Estadísticamente no se relaciona con el adenocarcinoma.[46]
- Cantidad de cigarrillos/día: los fumadores tienen un riesgo de 10 a 20 veces mayor de desarrollar cáncer de pulmón (según el número de cigarrillos fumados al día) que los no fumadores. Es decir hay una relación dosis-respuesta lineal.[44] Actualmente se usa más el índice paquetes-año, como medidor de intensidad tabaquica, obtenido a partir del número de cigarrillos fumados al día x años fumando /20.[47]
- Tendencia a aspirar el humo del tabaco: la inhalación profunda sobre todo si se fuma el último tercio del cigarrillo que se quema en los labios, porque ahí es donde se acumulan más sustancias tóxicas, predispone más al cáncer.
- Duración y comienzo del hábito de fumar: cuantos más años de la vida haya fumado una persona y sobre todo si es a una edad temprana, está más relacionado con cáncer ya que la dosis de cancerígenos es acumulativa.[47] Por ejemplo el riesgo aumenta entre 60-70 veces en un varón que fume dos cajetillas al día durante 20 años, en comparación al no fumador. Aunque el abandono del tabaquismo reduce el riesgo de contraer cáncer de pulmón, no lo reduce a los niveles de quienes nunca fumaron.[44]
- Abandono del hábito tabáquico:[48] el dejar de fumar durante 10 años reduce el riesgo a nivel de los controles (no fumadores). En los fumadores se producen alteraciones estructurales y funcionales en el epitelio bronquial (alteración de los cilios, hiperplasia mucosa con metaplasia escamosa, etc)[49] que tardan en desaparecer años una vez que se ha abandonado el hábito, hasta más de 13 años.
- Tabaquismo pasivo: se llama fumador pasivo la persona que no fuma pero que respira el humo del tabaco de los fumadores, ya sea en el hogar, en el trabajo o en lugares públicos. El fumador pasivo presenta niveles elevados de riesgo de contraer cáncer de pulmón, en relación al no fumador pasivo, pero inferiores en relación al fumador activo.[50] Existen personas que sugieren que el riesgo de contraer cáncer de pulmón es más elevado en los fumadores pasivos que en los fumadores activos, pero esto aún no ha sido demostrado conclusivamente, y dista de ser probable, por la mayor exposición del pulmón del fumador activo a los contaminantes cancerígenos del tabaco, en relación al fumador pasivo.
- Forma de presentación del tabaco: fumar puros, habanos o pipa tiene casi las mismas probabilidades de causar cáncer de pulmón que fumar cigarrillos. No hay evidencia de que fumar cigarrillos con bajo contenido de alquitrán reduzca el riesgo de cáncer de pulmón.[51] Se piensa que el cigarrillo perjudica más que el tabaco de puro o pipa por tres motivos:
- el pH del cigarrillo es ácido frente al alcalino del puro. El pH ácido se rechaza menos por la mucosa bronquial, la irrita menos, y por esto los cancerígenos van a estar más tiempo en contacto con ella.
- El papel del cigarrillo contiene alquitrán que encierra hidrocarburos cancerígenos.[49]
- El tabaco suave perjudica más que el fuerte porque irrita menos la mucosa bronquial. En esencia el tabaco rubio perjudica más que el negro.
- Marihuana: los cigarrillos de marihuana tienen mucho menos alquitrán que los de tabaco. Muchas de las sustancias del tabaco que causan cáncer también están en la marihuana. Algunos informes médicos indican que la marihuana podría causar cáncer de boca y de garganta. Sin embargo, debido a que la marihuana es una sustancia ilegal, no es fácil obtener información acerca de la relación que la marihuana tiene con el cáncer de pulmón en base a fundamentos moleculares, celulares e histopatológicos.[52]
- Grupos culturales: los grupos que defienden el no fumar como parte de su religión, como los mormónes[53] y los adventistas del séptimo día,[54] tienen tasas mucho menores de cáncer de pulmón y de otros cánceres asociados con el fumar.
- Asociación del tabaco con otros cánceres: el tabaco es el responsable del 30% de los cánceres en general y por orden de frecuencia decreciente son: labio, lengua, suelo de la boca, faringe, laringe, esófago: 75%. Vejiga urinaria: 30 %. Páncreas: 25%.[47]
Demostración clínica

La principal prueba clínica procede en gran parte de la observación de los cambios histológicos en el epitelio respiratorio de los fumadores,[44] donde existen en más del 90% células atípicas frente al 0,9% de los no fumadores.
La patogenia es la siguiente: el humo del tabaco llega a los alvéolos y allí los componentes hidrosolubles son absorbidos por la mucosa, no siendo absorbibles los liposolubles (brea o alquitrán) que contienen los hidrocarburos aromáticos policíclicos, los cuales son cancerígenos en animales.[55] La brea es fagocitada por los macrófagos alveolares y eliminada con los mismos en el esputo, pero no todos los macrófagos alveolares se van a eliminar en el esputo, muchos de ellos en su recorrido hacia la glotis se rompen dejando la brea libre.[56] Esta se va a depositar en la confluencia de los bronquios, sobre todo en los más superiores y periféricos, produciendo la irritación de los mismos. La brea irrita la mucosa y destruye la superficie del epitelio respiratorio obligando a la membrana basal a aumentar su capacidad proliferativa. La membrana basal aumenta tanto su “turn over” (hiperplasia de células basales con estratificación del epitelio), que termina produciendo metaplasia de las células escamosas, que evolucionará a displasia (carcinoma in situ) y finalmente a anaplasia como carcinoma in situ y carcinoma invasor.
Demostración experimental
Aunque las pruebas experimentales han venido en aumento en los últimos años, aún carecen de un vínculo importante, es decir, ha sido enfocada principalmente al intento de producir cáncer en animales de experimentación con extractos de humo de tabaco[44]. Se han encontrado más de 1200 sustancias, muchas de las cuales son carcinógenos potenciales como:
- Iniciadores: hidrocarburos policíclicos aromáticos (alquitranes: alfabenzopireno). Interactúan con el sistema enzimático arilhidrocarboxihidroxilasa produciendo intercambios de electrones que modifican los ácidos nucleicos.
- Promotores: derivados del fenol.
- Elementos radiactivos: Polonio 210, Carbono-14, Potasio 40.
Factores endógenos: genética y sexo

El cáncer de pulmón, igual que como ocurre en otras formas de cáncer, es iniciada por activación de oncogenes e inactivada por genes de supresión tumoral.[57] Los oncogenes son genes que parecen hacer que un individuo sea más susceptible de contraer cáncer. Por su parte, los protooncogenes tienden a convertirse en oncogenes al ser expuestos a determinados carcinógenos.[58]
- Sexo: en varios estudios se ha determinado que las células del pulmón de la mujer son más sensibles de contraer cáncer cuando se exponen al humo del tabaco.[44]
- Antecedentes personales y familiares: si se ha padecido un cáncer de pulmón, se tiene un mayor riesgo de contraer otro cáncer de pulmón. Los hermanos e hijos de las personas que han tenido cáncer de pulmón pueden tener un riesgo levemente mayor. Si el padre y el abuelo de un individuo murieron por cáncer de pulmón, este individuo si fuma, la causa más probable de su muerte será un cáncer de pulmón.
- Geografía y raza: hay una variabilidad en la incidencia.
- Factores genéticos:
- la existencia de un factor genético ligado a la enzima aril hidrocarbono hidroxilasa (AHH) que es una enzima del metabolismo del benzopireno. Se ha observado en algunos enfermos un incremento de la AHH, enzima que tiene la capacidad de convertir los hidrocarburos policíclicos en sustancias altamente cancerígenas.[47] También se ha detectado en otros casos de déficit de vitamina A, que al parecer tienen un efecto similar.
- Se ha demostrado la existencia de oncogenes activados en el tejido tumoral del cáncer de pulmón. Estos comprenden amplificación de los oncogenes myc en los tumores de células pequeñas, mutaciones puntuales en regiones codificadoras de oncogenes ras en distintas líneas celulares y activaciones mutacionales específicas del oncogen K-ras en tumores de células no-pequeñas como los adenocarcinomas.[59] En la actualidad se está estudiando si los incrementos o alteraciones de las proteínas expresadas por estos genes activados juegan algún papel en la patogenia del cáncer de pulmón.
- La inmunidad celular o humoral es un factor de susceptibilidad. Hasta ahora no se ha podido aclarar si la inmunodeficiencia es anterior o secundaria a la propia neoplasia.
- Conclusión: no se ha podido demostrar ningún factor responsable de la susceptibilidad genética. Cada día existe más evidencia de la participación de factores genéticos y otros biomarcadores de susceptibilidad en la predisposición al cáncer de pulmón.[47]
Heterocigosidad en el brazo corto del cromosoma 9p
Se ha visto que esta alteración está presente en más del 50% de los carcinomas de pulmón no microcítico. El significado de dicha alteración todavía no se conoce, pero se sabe que los daños a cromosomas pueden hacer que ocurra una pérdida de heterocigocidad. Ello puede favorecer la inactivación de genes de inactivación tumoral.[60]
Otros tipos de polimorfismo genético están asociados al cáncer de pulmón, como en el gen que codifica a la interleucina-1[61] al citocromo P450,[62] los promotores de la apoptosis tales como la caspasa-8,[63] y moleculas reparadores del ADN como la XRCC1.[64] Aquellas personas que contengan estos polimorfismos están más predispuestos a la aparición del cáncer de pulmón como consecuencia de una o repetidas exposiciones a carcinógenos.[49]
Riesgos industriales: trabajo y ocupaciones
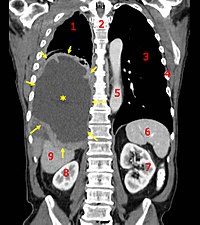
1. Pulmón derecho,
2. columna vertebral,
3. Pulmón izquierdo,
4. Costillas,
5. Aorta,
6. Bazo,
7. Riñón izquierdo,
8. Riñón derecho,
9. Hígado.
- Asbesto: es otro factor de riesgo para el cáncer de pulmón. Las personas que trabajan con asbesto tienen un riesgo mayor de padecer de cáncer de pulmón y, si además fuman, el riesgo aumenta enormemente.[11] Aunque el asbesto se ha utilizado durante muchos años, los gobiernos occidentales casi han eliminado su uso en el trabajo y en los productos para el hogar. El tipo de cáncer de pulmón relacionado con el asbesto, el mesotelioma, a menudo empieza en la pleura.
- Radón: el radón es un gas radiactivo que se produce por la descomposición natural del uranio. El radón es invisible y no tiene sabor ni olor. Este gas puede concentrarse en los interiores de las casas y convertirse en un posible riesgo de cáncer.[10]
Algunos trabajadores relacionados con la industria del asbesto, arsénico, azufre, (las tres Aes) cloruro de vinilo, hamatita, materiales radiactivos, cromatos de níquel, productos de carbón, gas mostaza, éteres de clorometilo, gasolina y derivados del diésel, hierro, berilio, etc., considerando que el no fumador tiene una probabilidad de 1 de padecer el cáncer de pulmón, que el fumador tiene 30 ó 40, el trabajador de estas industrias tiene un riesgo cinco veces aún mayor.[44] Todos los tipos de radiaciones son carcinogénicas. El uranio es débilmente radiactivo, pero el cáncer de pulmón es cuatro veces más frecuente entre los mineros de las minas de uranio no fumadores, que en la población general y diez veces más frecuente entre los mineros fumadores.
Contaminación urbana y atmosférica
Es concebible que los contaminantes de la atmósfera (especialmente la urbana) jueguen algún papel en el incremento de la incidencia del carcinoma broncogénico en nuestros días. El cáncer de pulmón es más frecuente en la ciudad que en el campo (1,3-2,3 veces superior entre varones con similar consumo de cigarrillos) debido a:
- Humos de motores de explosión (coches y vehículos a motor en general) y sistemas de calefacción. El dióxido de sulfuro, es una de las sustancias reductoras cancerígenas más importantes.
- Partículas de brea del pavimento de las calles.
- Partículas radiactivas.
- El gas radón natural y la radiactividad son muy abundantes en algunas zonas geográficas.[10]
Estos cuatro factores tienen un mecanismo de acción igual que el tabaco. Aunque la mayoría de los autores reconocen la existencia de un pequeño factor urbano en la incidencia del cáncer de pulmón, el principal culpable, con aplastante diferencia numérica, es el tabaco.
Cicatrización: patología bronquial previa
- Bronquitis crónica: se acepta que puede producir cáncer de pulmón.
- Tuberculosis: es una irritación crónica sobre el parénquima pulmonar que deja una cicatriz tuberculosa que favorece la aparición de cáncer de pulmón (scar carcinoma o cáncer sobre cicatriz, sobre todo el adenocarcinoma).
- Bronquiectasias, zonas de infarto pulmonar, inclusiones de cuerpos extraños, fibrosis pulmonar idiopática (el 10% muere por cáncer broncogénico), esclerodermia y cicatrices de otra naturaleza.
En más del 70% de los casos de scar carcinoma se trata de adenocarcinomas y la interpretación patogénica supone que la malignización sea debida a la proliferación atípica de células malignas en el proceso de regeneración epitelial de estas lesiones, o que hayan quedado atrapadas en el tejido de la cicatriz sustancias carcinógenas, como por ejemplo el colesterol en las lesiones tuberculosas antiguas; se teoriza que este atrapamiento se podría explicar por el bloqueo linfático ocasionado por la cicatriz, con acumulación de histocitos cargados de partículas virales o sustancias químicas. Sin embargo, en la mayoría de estos tumores, la fibrosis es secundaria al cáncer, en lugar de ser una lesión preexistente.
Virus
Se sabe que ciertos virus pueden causar cáncer de pulmón en animales[65][66] y evidencias recientes sugieren que tienen un potencial similar en humanos. La relación de los virus con el cáncer de pulmón tiene dos bases diferentes:
- En el ámbito experimental, se supone una incidencia de metaplasia del epitelio bronquial producida por paramixovirus, el Virus del Papiloma Humano,[67] el Papovirus SV-40, el virus BK, virus JC y el citomegalovirus.[68]
- En cuanto a la patología humana, se observa una vinculación con el carcinoma bronquioalveolar, probablemente por alteración del ciclo celular y la inhibición de la apoptosis, permitiendo división celular descontrolada.
Dieta
Algunos estudios concluyen que una alimentación con pocos alimentos de clase vegetal, podría aumentar el riesgo de cáncer de pulmón en personas que están expuestas al humo del tabaco. Es posible que las manzanas, las cebollas y otras frutas y alimentos de origen vegetal contengan sustancias que ofrecen cierta protección contra el cáncer de pulmón.
Se piensa que ciertas vitaminas, sobre todo las vitaminas A y C, son protectoras de las mucosa bronquial, por su capacidad de inactivar los radicales libres de los carcinógenos, o por su capacidad de regular de forma precisa ciertas funciones celulares, a través de distintos mecanismos. Sin embargo, no hay estudios que hayan podido demostrar que el uso prolongado de mulitivitaminas reducen el riesgo de desarrollar cáncer de pulmón.[69]
Pero se ha demostrado que el β-caroteno fue ineficaz como quimioprevención del cáncer de pulmón y que además dos extensos estudios,[70] de 18000 y 29000 participantes, respectivamente, demostraron que el consumo de beta-caroteno incrementó (en lugar de reducir) el riesgo de contraer cáncer de pulmón (18% de media), y particularmente en el caso de los fumadores de 40 o más cigarrillos diarios, que experimentaron un incremento en la incidencia del 42%. Desde el año 2007 no se recomienda el uso de β-caroteno como suplemento quimiopreventivo del cáncer de pulmón en individuos con antecedentes de consumo de cigarrillos mayor a 20 paquetes-año o con antecedentes familiares o personales de cáncer de pulmón.[71]
Irónicamente, durante el curso de estos estudios, el efecto carcinogénico del beta-caroteno se tradujo en un aumento de la mortalidad por cáncer de pulmón, precisamente en quienes consumieron beta-caroteno con la esperanza de proteger su salud. Esto sucedió tanto en aquellos que recibieron beta-caroteno solo o combinado con vitamina A o E. Investigaciones relacionadas a la vitamina E muestran evidencias concluyentes que esa vitamina tomada en grandes dosis, puede aumentar el riesgo de cáncer de pulmón, un riesgo especialmente exclusivo entre fumadores.[69] Los estudios especulan que el beta-caroteno, considerado tradicionalmente como un antioxidante podría metabolizarse a "pro-oxidante" una vez dentro del organismo humano.
Anatomía patológica
Localización del cáncer de pulmón

Desde el punto de vista topográfico predomina la localización en el pulmón derecho (relación 6:4), en los lóbulos superiores (quizá porque ésta es la localización más frecuente de la tuberculosis pulmonar) y dentro de éstos el segmento anterior. En segundo lugar se localiza en los lóbulos inferiores y en tercer lugar en el lóbulo medio y língula. El tumor de Pancoast es el tumor maligno situado en el ápex pulmonar, que aparece en el 4% de los casos y no es una variedad histopatológica.[72] Según la localización, el cáncer de pulmón se clasifica en:
- Cáncer de pulmón central: aparece a nivel de bronquios principales, lobares y segmentarios (primera, segunda y tercera generación respectivamente), hasta los de cuarta generación, es decir preferentemente en y alrededor del hilio pulmonar.[73] El origen traqueal es raro, cerca del 1%. Se inicia con sintomatología bronquial y son accesibles con el broncoscopio. Representan el 75%. Son cánceres centrales las variedades epidermoide y el carcinoma indiferenciado de células pequeñas.
- Cáncer de pulmón periférico: aparece a partir de los bronquios de quinta generación. Se inicia con clínica extrabronquial y no son accesibles con el broncoscopio. Son cánceres periféricos el adenocarcinoma. Rara vez llegan a localizarse en áreas muy alejadas, junto a la pleura.
Aspecto macroscópico
En su desarrollo, el carcinoma pulmonar, comienza como un área de atipia citológica in situ, que durante un periodo de tiempo no conocido produce una zona de engrosamiento de la mucosa bronquial. A partir de aquí puede seguir uno de varios patrones:
- Ulceración tumoral de la mucosa: el pequeño foco, generalmente de menos de 1 cm de diámetro, al progresar adquiere el aspecto de una excrecencia verrucosa que eleva y erosiona el revestimiento epitelial. Tiene bordes mamelonados de contorno irregular.
- Tumor intrabronquial: forma una prominencia que ocupa la mayor parte de la luz del bronquio.[74]
- Infiltración circular estenosante: de crecimiento predominantemente submucoso, aunque suele acabar ulcerándose.
- Infiltración peribronquial: el tumor penetra rápidamente en la pared bronquial e infiltra el tejido peribronquial, hacia la carina o mediastino.[75]
- Invasión del parénquima: a partir de una de las formas anteriores, puede alcanzar tamaños considerables según el tiempo transcurrido hasta que se hace el diagnóstico, constituyendo una masa sólida, de consistencia firme a dura, de color grisáceo o blanquecino al corte, con algunas zonas amarillentas y focos hemorrágicos. El tumor crece en un frente amplio produciendo una masa intraparenquimatosa en forma de coliflor que desplaza el tejido pulmonar adyacente.
- La necrosis tumoral es frecuente en la variedad epidermoide, con formación de una cavidad central que termina por infectarse muchas veces. Esta necrosis es expresión de falta de vascularización del tumor, que se realiza a través de los vasos bronquiales, y que apenas permite el aporte sanguíneo de las zonas centrales.
- Areas de hemorragia: aparecen muchas veces asociadas a áreas de necrosis tumoral, sobre todo cuando el tumor es prominente, lo que da lugar a un moteado amarillo blanquecino y a reblandecimiento.
- Lesiones secundarias: Otras lesiones asociadas son la atelectasia distal, la infección neumónica también distal a la obstrucción bronquial causada por el tumor y las bronquiectasias regionales.
Extensión o crecimiento del cáncer de pulmón
En el momento del diagnóstico sólo el 20% tienen extensión localizada, el 25% tienen extensión a los ganglios linfáticos y el 55% tienen metástasis a distancia.
- Diseminación directa: infiltración: el cáncer comienza en un punto determinado de la mucosa y a partir de ahí tiene un crecimiento hacia el interior y exterior de la luz bronquial, ascendente y descendente a través de la submucosa y un crecimiento circunferencial.
- Crecimiento submucoso: puede abarcar toda la circunferencia bronquial y sobrepasar los límites macroscópicos. A mayor crecimiento submucoso, más irresecable será el cáncer. Si no se puede extirpar un centímetro más allá del límite macroscópico, el tumor será irresecable. En su crecimiento el tumor infiltra la pared bronquial, afectando al plexo linfático submucoso, y extendiéndose después por el parénquima pulmonar según los planos intersticiales, incluido el tejido conjuntivo perivascular de los vasos pulmonares.
- El crecimiento intrabronquial será el responsable de la sintomatología bronquial como tos, hemoptisis, enfisema, atelectasia, etc.[73]
- El crecimiento extrabronquial será responsable de la sintomatología extrapulmonar intratorácica, derivada de la invasión de estructuras como el mediastino, pared torácica, diafragma, venas cavas, pericardio, tumor de Pancoast, etc. La pleura visceral, que inicialmente resiste la propagación, acaba por ser invadida, infiltrándose entonces diversas estructuras intratorácicas (nervios, pericardio, etc.) o diseminándose por la superficie pulmonar (implantaciones transpleurales) o a la pleura parietal, que si es invadida también, rápidamente se verá complicada la evolución con la progresión del tumor por la pared torácica, con la afectación de estructuras óseas. En este tipo de invasión, hay primero formación de adherencias pleurales, diseminándose después las células neoplásicas a través de los vasos linfáticos neoformados a partir del plexo linfático subpleural. Esta participación linfática es muy importante y precoz en los tumores del vértice pulmonar, en conexión con el sistema linfático perineural del plexo braquial, lo que tendrá una traducción clínica importante.
El crecimiento intra y extrabronquial es constante en todo cáncer de pulmón. Sólo el 20% de los casos, el cáncer se diagnosticará en el parénquima pulmonar (localizado), y es el que tiene mejor pronóstico.
- Diseminación linfática: la frecuencia de la afectación ganglionar varía ligeramente según el patrón histológico, pero oscila alrededor del 50%.
- a) Bases anatómicas del drenaje linfático:
- Linfáticos pulmonares: se incluyen aquí la red linfática subpleural y los ganglios lobares e interlobares; de éstos, tienen especial importancia los situados entre el bronquio lobar medio (pulmón derecho), o segmentarios de la língula (pulmón izquierdo), y el bronquio del segmento apical del lóbulo inferior (segmento 6), ya que por sus conexiones interlinfáticas drenan linfa de todos los lóbulos en un mismo pulmón. Los ganglios hiliares representan el límite entre este grupo pulmonar y el extrapulmonar.
- Ganglios extrapulmonares: son los ganglios subcarinales, situados debajo de la bifurcación traqueal, y los ganglios paratraqueales. Los ganglios mediastínicos anteriores y paraesofágicos representan ya estaciones ganglionares alejadas.
- Ganglios extratorácicos: los grupos más importantes son el supraclavicular, los paraaórticos abdominales, los cervicales y los axilares.
El 25% de los casos diagnosticados de cáncer de pulmón, ya presentan ganglios linfáticos regionales afectados. Al considerar la diseminación linfática del carcinoma broncogénico, hay que tener en cuenta la existencia de conexiones entre los diferentes grupos señalados, y el hecho de que la obstrucción linfática neoplásica acabará por provocar una diseminación por vías colaterales, por lo que los esquemas anatómicos tienen un valor relativo.
- b) Territorios linfáticos pulmonares: son tres:
- Superior: comprende el lóbulo superior, con excepción de las porciones posterior y lateral en el lado derecho, y la porción lingular y parte del segmento anterior en el izquierdo. El drenaje linfático se hace hacia los ganglios paratraqueales y después a los ganglios supraclaviculares ipsilaterales (en el lado izquierdo hay también una importante vía de propagación a los ganglios mediastínicos anteriores).
- Medio: con las porciones antes excluidas de los lóbulos superiores y el lóbulo medio y el segmento 6 del lóbulo izquierdo inferior. El drenaje linfático se hace preferentemente a los ganglios subcarinales, y de éstos, a los paratraqueales del lado correspondiente aunque a veces, sólo a los paratraqueales derechos.
- Inferior: representado por todo el lóbulo inferior, excepto el mencionado segmento apical o segmento 6. El drenaje linfático se hace a los ganglios subcarinales paratraqueales derechos. Los tumores de este territorio inferior presentan con frecuencia afectación de los ganglios situados en el ligamento pulmonar (funcionalmente, éstos tienen el mismo significado fisiológico que los ganglios hiliares), desde donde progresan a los ganglios subcarinales o, más rara vez, a los paraesofágicos.
Teniendo en cuenta la continuidad directa de los ganglios paratraqueales con los supraclaviculares, se puede establecer que todos los cánceres de pulmón derecho y los localizados en el lóbulo inferior izquierdo podrán invadir los ganglios de la fosa supraclavicular derecha, a través de la gran vena linfática; en cambio, los ganglios supraclaviculares izquierdos se afectarán exclusivamente en los tumores del lóbulo superior izquierdo, por el conducto torácico.
- c) Linfangitis carcinomatosa: es un cuadro anatomopatológico muy peculiar, caracterizado por presentar una amplia zona del pulmón un aspecto edematoso y atelectásico, con regueros de infiltración que de forma radiada se extienden desde la región hiliar hacia la trama linfática subpleural periférica. Considerada hace algunos años de naturaleza metastásica, en realidad se trata de una infiltración difusa en sentido centrífugo desde los ganglios hiliares bloqueados por la proliferación de células neoplásicas hacia el plexo subpleural.
- Diseminación hemática: metástasis a distancia El 55% de los cánceres de pulmón presentan ya metástasis a distancia en el momento del diagnóstico. Las metástasis a distancia son frecuentes, hecho que se justifica por la afectación relativamente precoz de los vasos venosos pulmonares; en la variedad histopatológica de tumores anaplásicos de células en grano de avena es casi sistemática, lo que tiene un pésimo significado pronóstico. Las metástasis afectan preferentemente, y en orden decreciente a hígado (30-50%), cerebro (20%), esqueleto(20%) y riñón, siendo también alta la incidencia en las glándulas suprarrenales, lo que se observa en cerca del 30-50% de las auptosias de enfermos fallecidos por carcinoma broncogénico. Tal vez se trate del resultado de una diseminación linfática distante por conexión de los ganglios paraaórticos con otros grupos retroperitoneales, y no por vía hematógena. Finalmente, también hay que citar las metástasis en el propio pulmón, como resultado de una embolización a través de la arteria pulmonar. No obstante, la existencia de varias masas tumorales, unilaterales o bilaterales, hace también considerar que se trate de diseminaciones broncógenas, como se admite en los tumores bronquioalveolares.
Clasificación histopatológica según la OMS
Los distintos tipos histológicos tienen diferente evolución natural y por tanto, como paso previo al tratamiento es necesario un diagnóstico histológico preciso realizado por un anatomopatólogo experto. Las principales decisiones con respecto al tratamiento se toman en la distinción crucial entre la clasificación histológica de un tumor con un carcinoma de células pequeñas y los que no corresponden a este tipo, que corresponden a los epidermoides, adenocarcinomas, carcinoma de células grandes, carcinoma bronquioalveolar y formas mixtas.
El 95% de las neoplasias malignas de pulmón se clasifican en:
- Carcinoma epidermoide pulmonar o carcinoma de células escamosas pulmonar
- Carcinoma microcítico pulmonar
- Adenocarcinoma pulmonar
- Carcinoma indiferenciado de células grandes pulmonar o de células gigantes o anaplásico de células grandes
- Carcinoma bronquialveolar
Diagnóstico
En la mayoría de los pacientes el diagnóstico se plantea ante datos clínicos y cuando en un estudio radiológico se detecta alguna anormalidad pulmonar. Con menos frecuencia se tratará de precisar el diagnóstico en enfermos a los que en un estudio rutinario radiológico se les ha puesto de manifiesto una imagen sospechosa o bien se intenta localizar el tumor ante un estudio histológico que muestra células neoplásicas. Los objetivos a cumplir para el diagnóstico de cáncer de pulmón son:[73]
- Sospecha clínica por la sintomatología (es inespecífica y subjetiva), sobre todo en la población de riesgo que la componen fumadores varones de más de 45 años.
- Localización con radiología de tórax y otras pruebas complementarias.
- Conocer el tipo histológico del tumor ya que confirma el diagnóstico.
- Determinar el estadio del cáncer de pulmón. Ésta junto con las características histológicas del tumor son los dos objetivos fundamentales de todas las exploraciones diagnósticas.
- Valorar el estado general del paciente.
- Decidir el tratamiento manejando las características anteriores.
Radiografía simple de tórax

Es una de las primeras exploraciones complementarias que debe realizar un profesional de la salud. Se prefiere una radiografía posteroanterior que visualiza el 70% de los pulmones y otra lateral que visualiza el 30% restante. En las radiografías simples de tórax se puede observar alguna anormalidad en casi el 98% de los pacientes con un carcinoma broncogénico, y el 85% son imágenes sugestivas para sospechar el diagnóstico por las alteraciones pulmonares distales (atelectasia), la existencia de adenopatías (ensanchamiento mediastínico) o detección de invasión torácica, incluida la pared. La radiografía de tórax detecta el 75% de los cánceres de pulmón. No se recomiendan las tomas radiológicas en serie para la detección temprana del cáncer de pulmón.[71] La radiografía simple de tórax suele diagnosticar el 5-15% de los cánceres pulmonares en pacientes asintomáticos. En ella se puede observar:
Tumoración
Manifestaciones radiológicas determinadas por la tumoración:
- Nódulo pulmonar solitario: aparece en un 33% de los cánceres de pulmón. Es la imagen más importante para el diagnóstico diferencial. Suele ser un hallazgo radiológico casual. Suelen corresponder a adenocarcinomas e indiferenciado de células grandes. Se localizan en la periferia del pulmón. Morfológicamente son de aspecto denso, redondeado, de contorno lobulado, irregular y espiculado, con tractos lineales dirigidos hacia el hilio. No se calcifica, por lo que la presencia de calcificaciones suele ser consecuencia de su englobamiento por la masa tumoral o del origen del tumor en el seno de una cicatriz (hecho frecuente). Su tamaño es inferior de 3-4 cm de diámetro.
- Masa tumoral: aparece en el 28% de los cánceres de pulmón. Suele ser de tamaña superior a los 5 cm. Se localiza normalmente en el hilio y suelen corresponder a carcinoma microcítico pulmonar o indiferenciado de células grandes.
- Neumonía: suele ser persistente de pobre resolución (infiltrado pulmonar). Aparece en el 25 % de los cánceres de pulmón. Se observa como una densidad de agua poco definida. Cuando se observa una masa periférica con broncograma aéreo hay que pensar en el carcinoma bronquiolar (variante del adenocarcinoma) que es un tipo histológico que comienza en el alvéolo a nivel del neumocito tipo II dando una imagen similar a una bronconeumonía pues se observa relleno de acinos alveolares de sangre o pus. El bronquiolar es el único cáncer que puede ser multicéntrico.
- Cavitación y bulla: no es un parámetro radiológico importante, ya que sólo aparece en el 2-10% de los cánceres de pulmón. Suelen ser epidermoides centrales, la mayoría. Ocurre sobre todo en el lóbulo superior y en el segmento 6. Pero los periféricos también se cavitan como el adenocarcinoma y en el carcinoma de células grandes. Son condensaciones de bordes irregulares con cavitación. La llamada célula de avena no suele cavitarse. Es cavitación cuando tiene un grosor de su pared mayor de 2-3 cm. Es bulla cuando tiene un grosor menor de 2-3 cm. En ambos casos se puede observar un nivel hidroaéreo. La cavidad, consecuencia de la necrosis del tumor por isquemia, es de tamaño variable, de paredes gruesas, con borde interno de aspecto mamelonado y de contorno externo irregular con neumonitis adyacente. Pueden confundir con abscesos pulmonares.
- Condensación que ocupa el vértice pulmonar: la producen neoplasias situadas en el seno vertebropulmonar superior (tumor de Pancoast). Estas se originan en el parénquima pulmonar del vértice y en su crecimiento invaden la pleura extendiéndose a la base del cuello. Acaban afectando la pared torácica adyacente (destrucción de primeras costillas), invadiendo el simpático cervical y el plexo cervical (síndrome de Horner y síndrome radicular, respectivamente), y dificultando, por compresión e invasión, el drenaje de la vena cava superior (edema en esclavina, desarrollo de circulación colateral en región anterosuperior del tórax, hombro y brazo, etc). Aunque puede ser de cualquier variedad histológica, predomina el epidermoide.
- Metástasis pulmonares: en el carcinoma de pulmón pueden aparecer depósitos metastásicos pulmonares en forma de nódulos múltiples redondeados, bien definidos, de diferentes tamaños. Puede parecerse a las metástasis de cualquier otro origen o bien estar cavitadas, sobre todo cuando el primario es de origen epidermoide. La presencia de metástasis pulmonares en el carcinoma broncogénico es de aproximadamente el 7%, afectándose el pulmón ipsilateral en la mitad de los casos, el pulmón contralateral en la cuarta parte y ambos pulmones en el resto.
- Linfangitis carcinomatosa: al igual que otros tumores, el carcinoma bronquial puede producir linfangitis carcinomatosa más frecuentemente unilateral. El patrón radiológico se traduce en la identificación de líneas B de Kerley (evidencia de edema), algunas veces asociadas a un componente nodular, posiblemente por la existencia de depósitos hematógenos, que crean un patrón de aspecto reticulonodular. La linfangitis carcinomatosa no siempre es reconocida por radiología simple, pudiendo ser un hallazgo de auptosia.
- Destrucción ósea: según diferentes estadísticas oscila entre el 10 y el 20% de los casos. Las lesiones son fundamentalmente de tipo osteolítico, aunque puedan existir lesiones puramente osteoblásticas en el carcinoma de células pequeñas y en el adenocarcinoma. Los huesos afectados más frecuentemente son las vértebras (70%), la pelvis (40%) y el fémur (25%). La invasión directa de la pared torácica aparece en auptosias en el 10% de los casos.
Invasión de gánglios linfáticos
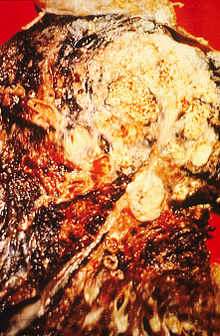
Manifestaciones derivadas de la invasión ganglionar por células tumorales Los tumores centrales se manifiestan en primer lugar por un aumento de la sobra hiliar y en segundo lugar por ensanchamiento del mediastino. Más tardíamente atelectasias, hiperinsuflación, etc.
- Ensanchamiento hiliar uni o bilateral: En tumores de localización central suele ser suma de masa tumoral y del agrandamiento de ganglios hiliares. Esta imagen se presenta con relativa frecuencia (12-28% de los enfermos). La evidencia de una masa periférica o central (tumor originario), incluso neumonía y de manifiestas adenopatías hiliares debe hacer pensar en el carcinoma de pulmón en el adulto. Puede ser el único signo radiológico, siendo en ocasiones difícil de reconocer, teniéndose que recurrir a otras técnicas complementarias como la TAC.
- Afectación de ganglios mediastínicos: se manifiesta como masas generalmente unilaterales de contornos lobulados o policíclicos. En estos casos es frecuente la existencia de otros signos radiológicos y de síntomas derivados de la compresión e invasión de estructuras mediastínicas: afonía por parálisis del nervio laríngeo, disfagia por compresión o infiltración del esófago a partir de ganglios carinales o mediastínicos posteriores, síndrome de la vena cava superior en tumores del vértice, etc. El mediastino superior es el más frecuentemente afectado, produciendo un aspecto convexo lobulado. Sospecharemos tumor microcítico cuando el tumor no sea muy grande y tengan muchas adenopatías mediastínicas, hiliares, etc y precisará diagnóstico diferencial con linfoma.
Invasión de estructuras vecinas
Algunas evidencias radiológicas derivan de la invasión a estructuras vecinas o del crecimiento intraluminal del cáncer de pulmón:
- Invasión de la pared costal: aparece destrucción de las costillas en el tumor de Pancoast o en tumores periféricos de cualquier localización.
- Parálisis diafragmática: es frecuente la elevación diafragmática e inmovilidad del hemidiafragma ipsilateral, secundaria a parálisis del nervio frénico por invasión mediastínica del carcinoma de pulmón, siendo la primera causa de parálisis diafragmática del adulto.
- Derrame pleural: aparece en el 8-15% de los cánceres pulmonares. Cuando se observe un derrame amplio sin desplazamiento contralateral del mediastino, debe sospecharse el cáncer de pulmón por mediastino fijo por infiltración tumoral. También puede cursar con desplazamiento del mediastino hacia el lado contrario. Es producido por cualquier tipo histológico. Sería un tumor Tx porque sabemos que existe neoplasia pero no conocemos su localización. El derrame puede ser seroso o sanguinolento, y no siempre significa invasión directa de células de estirpe neoplásica. El derrame seroso es frecuentemente el resultado de la obstrucción de los ganglios linfáticos invadidos o atelectasia obstructiva, mientras que la existencia de derrame hemorrágico casi siempre denota invasión directa por parte del tumor.
- Síndromes obstructivos de vías aéreas: pueden aparecer acompañados de la evidencia de la masa tumoral; pero en ocasiones, y dado el origen epitelial de estos tumores, pueden constituir la única manifestación incluso muy precoz, de la enfermedad. Comprenden:
- Neumonitis obstructiva: con evidente o sólo discreta pérdida de volumen. La condensación neumónica suele ser mucho más densa y homogénea que en la neumonía bacteriana y la infiltración parenquimatosa suele desbordar las cisuras.
- Atelectasia: la mayoría de los carcinomas de pulmón producen oclusión bronquial con consolidación y atelectasia del tejido periférico, siendo la atelectasia la manifestación radiológica más frecuente del carcinoma broncogénico. Puede ser completa o incompleta sin broncograma aéreo. Esta puede afectar a un bronquio segmentario o lobar e incluso a todo el pulmón (obstrucción del bronquio principal). En la atelectasia lobar por cáncer es frecuente que el colapso del lóbulo sea irregular, ya que la masa impide la retracción allí donde está situada; ello hace que la cisura correspondiente al retraerse adopte la forma de una S (signo de Golden). Otras veces existe el signo de rotura de la cisura. Aparece en cáncer epidermoide y microcítico y de células grandes. Se forma porque asienta sobre la división de bronquios principales: Si existe ocultamiento del hilio izquierdo es por pérdida de volumen del lóbulo inferior. Si existe atelectasia de lóbulo inferior izquierdo se pierde volumen y el hilio se mete detrás del corazón. Puede confundirse con una lesión neumónica, por lo que la TAC nos puede ayudar en el diagnóstico diferencial al identificar en la mayoría de los casos la masa o la obstrucción bronquial.
- Enfisema obstructivo: atrapamiento aéreo localizado: se produce por efecto valvular del propio tumor (obstrucción bronquial incompleta) que permite la entrada de aire pero dificulta su salida en la espiración. En ocasiones puede objetivarse comparando radiografías en inspiración y espiración.
Tomografía axial computarizada

La tomografía axial computarizada es de gran utilidad en el cáncer de pulmón y se recomienda en todo paciente con un nódulo pulmonar solitario detectado por radiografía.[71] Algunas ventajas de una tomografía incluyen: - Encuentra su principal aplicación en la determinación del grado de extensión de la neoplasia; tanto intratorácica como extratorácica, y de las adenopatías mediastínicas. - En la diferenciación entre nódulos benignos y malignos, además de la detección de pequeños nódulos con mayor nitidez que en las radiografías simples. Proporcionan valiosa información sobre la existencia de cavitación, calcificación y en ocasiones la localización intrabronquial del tumor, en fin, de las características morfológicas del tumor.
- En el análisis de lesiones subpleurales y en la visualización de pequeños derrames
- Afectación de pared, ya que permite una correcta visualización de la pared costal.
- Visualización de la extensión del tumor a otras estructuras colindantes.
La experiencia obtenida en estos últimos años permite afirmar que es una exploración de gran utilidad en la evaluación preoperatoria de los tumores pulmonares, al ser un método muy demostrativo de la afectación mediastínica del carcinoma de pulmón, de la evaluación de los ganglios retroperitoneales, crurales, así como del estado del hígado, suprarrenales y riñón, frecuentemente afectados por metástasis.
Broncoscopia
La broncoscopia, sin duda, se trata de las exploraciones más importantes para el diagnóstico del cáncer de pulmón. Existen dos procedimientos diferentes para su realización: el rígido y el flexible. Ciertamente, desde la aparición de los broncoscopios flexibles, las posibilidades de la técnica han aumentado considerablemente. Con el broncoscopio rígido se puede explorar un amplio territorio bronquial que comprende tráquea, bronquios principales y bronquios lobares inferiores en visión directa. Por medio de ópticas es posible llegar a visualizar la salida de los bronquios lobares superiores. Por tanto, su limitación viene dada por la imposibilidad de introducirse en bronquios segmentarios y obtener muestras de lesiones periféricas. Por el contrario, el broncofibroscopio consigue una visualización prácticamente total del árbol bronquial, llegando a territorios realmente periféricos, obteniéndose, sin duda, un aumento considerable de la rentabilidad. La broncoscopia rígida apenas se utiliza quedando completamente desplazada por la fibrobroncoscopia.
- Rentabilidad: en el cáncer de pulmón es muy alta, alcanzándose el diagnóstico hasta en el 93% de los casos cuando la lesión es visible endoscópicamente y en, aproximadamente, el 50% cuando no lo es (rentabilidad global del 87%). Se puede decir que la broncoscopia tiene una sensibilidad del 50% y una especificidad del 95%.
- Indicaciones:
- Es una técnica obligada si el paciente no expectora o el estudio citológico es negativo, para poder establecer o descartar el diagnóstico.
- Si éste ya ha sido hecho mediante citología, para reafirmar o precisar el tipo histológico y para determinar su localización o extensión.
- Ante una lesión central visualizada en la radiografía de tórax o en el TAC.
Fines de la broncoscopia
- Permite la visualización directa del tumor ya que la mayoría de los tumores son centrales y accesibles con esta técnica exploratoria.[73] Por ejemplo puede visualizar la mucosa desestructurada, friable y muy vascularizada. También la broncoscopia es útil para la aplicación del estudio de la fluorescencia persistente en los tejidos neoplásicos: actualmente se emplea un derivado de hematoporfirina, inyectado por vía intravenosa, y que se concentra preferentemente en tejidos cancerosos. Al ser expuesto este tejido a la luz ultravioleta (se emplea como fuente de luz monocromática los rayos láser), emite una fluorescencia rojoanaranjada; también se ha aplicado sobre este mismo principio de fluorescencia un detector fotoeléctrico incorporado al broncofibroscopio: el detector genera una señal auditiva cuando el tejido neoplásico fluorescente está dentro del campo visual del fibroscopio.
- Determina la extensión y localización intrabronquial: esta es la ventaja que se obtiene con respecto a la PAAF. Si el tumor es resecable se puede saber hasta donde se puede resecar. Siempre será necesario conocer con vistas a la resecabilidad la distancia entre carina principal y la infiltración tumoral.
- Permite la toma de biopsia de la lesión: existen diversas modalidades:
- Biopsia directa del tumor que se está visualizando.
- Biopsia transbronquial, si no hay biopsia directa del tumor.
- En tumores sin visión directa permite hacer:
- Cepillado bronquial con Telescopaje: consiste en la introducción de un escobillón por el fibroscopio para la toma de muestra para citología. Se suele hacer en tumores periféricos, la realización de fibrobroncoscopia bajo control radiológico con el fin de poder dirigir con mayor precisión las pinzas de biopsia o el cepillo al lugar de la lesión
- BAS: Broncoaspiración selectiva: consiste en la aspiración del bronquio distal para hacer citología. Se obtiene conectando un sistema de aspiración al canal del fibroscopio.
- BAL: Lavado broncoalveolar: se realiza enclavando el fibrobroncoscopio en un segmento bronquial y procediendo a la introducción y aspiración de pequeñas cantidades repetidas de suero fisiológico. El análisis citológico del sedimento, tras centrifugado, traduce la situación de actividad de procesos intersticiales y tumorales.
- Punción transbronquial: en caso de abombamiento o compresión de bronquios principales, traquea o carina, se puede hacer una punción aspiración transbronquial o transcarinal y obtener así material de estas adenopatías para examen histológico. La mayor utilidad de la biopsia transbronquial son los procesos pulmonares difusos. Un resultado negativo no excluye el diagnóstico, y además, las complicaciones de hemorragias y neumotórax no son despreciables.
- Informa sobre los datos de diseminación del tumor, como por ejemplo si la carina deja de ser móvil o su ángulo se ve aumentado, lo que refleja la afectación de los ganglios subcarinales que es una contraindicación quirúrgica. Es decir informa de signos indirectos de compresiones (como por ejemplo la obstrucción de algún bronquio) o desviaciones bronquiales por adenopatías.
- Complicaciones: la broncoscopia tiene complicaciones en el 10% de los casos y una de ellas es la hemoptisis en la misma intervención, que suele ser expectoración hemoptoica y rara vez hemoptisis franca, y que por lo general cede espontáneamente en 24-48 horas. También se pueden dar sustancias procoagulantes para disminuir la hemorragia. Cuando se realizan biopsia transbronquial de lesiones muy periféricas pueden aparecer neumotórax, casi siempre pequeños, que ocasionalmente precisan drenaje endotorácico. Otras complicaciones son infecciones, insuficiencia respiratoria, arritmias, edema de glotis y broncoespasmo.
- Contraindicaciones: no existe contraindicación absoluta alguna. El mayor riesgo de complicaciones incide en enfermos con cardiopatía isquémica, insuficiencia respiratoria severa, asma bronquial sintomático y diátesis hemorrágica.
Estudio histopatológico
Citología
La citología del esputo es el procedimiento diagnóstico más habitual y debe constituir la primera técnica a utilizar en todo enfermo subsidiario de padecer un cáncer de pulmón, bien porque así lo sugieren la clínica y la radiología, bien porque, aún no siendo sugerentes, o se trate de un enfermo de alto riesgo. A partir del año 2007, no se recomienda realizar una citología de esputo individual o en serie para el tamizaje en el cáncer de pulmón.[71] Un citólogo experto no sólo limita su información al diagnóstico genérico de cáncer, sino que en la mayoría de los casos llega a su tipificación histológica.
- Se requiere examinar al menos tres muestras para conseguir un buen rendimiento diagnóstico. Si se analiza el esputo de forma seriada, por ejemplo, tres muestras en días distintos, por un citólogo experto y las muestras son de buena calidad, esputo reciente, matutino, procedente de vías profundas y transportado en alcohol de 50, la rentabilidad diagnóstica media es alta (75-85%), especialmente si una de las muestras se obtiene horas después de la fibrobroncoscopia. La rentabilidad es mayor, alcanzando el 90%, cuando el cáncer es de localización central, y desciende considerablemente, al 50%, en los tumores periféricos.
- La única limitación que presenta es que el enfermo no sea capaz de expectorar. Si el paciente es incapaz de expectorar, se puede intentar inducir el esputo mediante aerosol salino hipertónico.
- Su especificidad es muy alta. Los falsos positivos son escasos (2-3%) y suelen producirse en sujetos afectados de procesos inflamatorios crónicos.
- El carcinoma escamoso es el que proporciona mayor índice de citologías positivas.
- Citología con broncoscopia: consiste en abrasión bronquial con cepillos adecuados.
- Citología del derrame pleural: si existe derrame por toracocentesis. Si existe cáncer se observa un aumento de LDH mayor que en plasma. Aunque su significado no es patognomónico, la ausencia de elevación, excluye casi con seguridad que el derrame esté asociado a un cáncer. Hay que hacer tres determinaciones seriadas.
- PAAF. Punción aspiración con aguja fina: es una punción aspirativa transparietal. Tiene una sensibilidad del 80% y una especificidad del 95%. Sólo está indicada en tumores periféricos no accesibles a la fibrobroncoscopia o en tumores de situación media en los que reiteradamente ha fallado ésta (obtención de material inflamatorio o necrótico). En masas de 3-4 cm de diámetro o mayores se alcanza una rentabilidad alrededor del 80%, pero consigue obtener material de lesiones tan pequeñas como nódulos de 1 centímetro de diámetro. La zona a pinchar se localiza con TAC. Cada vez se hace con agujas más finas (diámetros de décimas de milímetro) para evitar el neumotórax que ocurre en el 5-6% en la actualidad, hemoptisis: 5%, necesidad de toracocentesis: 1%.
En caso de ganglios cervicales palpables se puede ir directamente a su punción o biopsia. Igualmente si existe infiltración difusa supraclavicular.
La limitación principal de la PAAF es su aproximación diagnóstica, que se hace a través de un estudio citológico, lo que en ocasiones aporta menos datos que un estudio biópsico. No obstante, el índice de rentabilidad es alto y la morbilidad se encuentra muy disminuida respecto a la biopsia pulmonar transparietal.
Biopsia
La biopsia entrega la máxima certeza al diagnóstico. Hay distintas modalidades dependiendo de las circunstancias clínicas:
- Biopsia bronquial o transbronquial: en el curso de una fibrobroncoscopia.
- Biopsia ganglionar: obtenido mediante mediastinoscopia.
- Biopsia percutánea de ganglios palpables: se debe explorar las fosas supraclaviculares y si existen adenopatías se deben biopsiar.
- Biopsia de Daniel o biopsia de ganglios escalénicos: consiste en extirpar la grasa preescalénica y estudiarla histopatológicamente. Si el estudio es positivo, es un criterio de inoperabilidad. La escasa correlación entre una biopsia negativa y la posibilidad de resección de un carcinoma de pulmón ha hecho que esta técnica haya sido prácticamente abandonada. Se tiene la impresión de que es poco útil por el pequeño número de positividades que proporciona, pero esto se debe, en gran parte, al error de efectuar la extirpación de la grasa preescalénica, cuando realmente lo que se debe examinar son los ganglios supraclaviculares de la confluencia yúgulosubclavia, que son los que drenan linfa pulmonar, y que se reconocen por contener contenido antracótico.
- Biopsia de masa de partes blandas: se biopsiará las lesiones sospechosas accesibles si aún no se ha establecido el tratamiento o si la determinación del estadio se basa en el hecho de que una determinada lesión sea o no cáncer.
- Biopsia ósea de una lesión osteolítica: se determina por la radiología del hueso afecto o por gammagrafía ósea.
- Biopsia de médula ósea: se suele hacer una punción de cresta ilíaca sobre todo en oat-cell que suele metastatizar en médula ósea frecuentemente.
- Biopsia pleural: si es tumor periférico y existe derrame pleural. Se puede hacer con diferentes tipos de aguja, siendo la más empleada la de Vim-Silverman. Se requiere anestesia local y la existencia de una cámara líquida a aérea dentro de la cavidad pleural, que permita introducir la aguja de biopsia libremente y sin riesgo de lesionar el parénquima pulmonar. Si bien esto no es ningún inconveniente para la técnica, ya que su indicación principal es en aquellos procesos torácicos que cursan con la aparición de derrame pleural, cuyo origen no ha podido ser filiado por otros procedimientos. El único inconveniente que se puede poner a esta técnica viene dado por la imposibilidad de seleccionar el territorio pleural que se quiere biopsiar. Es decir, se trata de un procedimiento ciego, lo que repercute sobre la variabilidad de la rentabilidad. No obstante, dado su escasa o nula morbilidad, permite la repetición sucesiva de la técnica sin graves inconvenientes. No será un procedimiento ciego, cuando se visualicen masas pleurales en la TAC.
- Biopsia pulmonar percutánea o transparietal o transpleural: se realiza generalmente con control radiológico. Existen diversos métodos como la biopsia aspirativa, la biopsia con aguja cortante y el taladro ultrarrápido de aire comprimido. La principal indicación es en aquellos tumores periféricos de difícil o imposible acceso por otros procedimientos. Lo cierto es que con el perfeccionamiento de la biopsia transbronquial, con control radiológico y la PAAF, los casos en los que es preciso realizar esta técnica son muy escasos. En más del 80% de los tumores se obtienen muestras suficientes para establecer el diagnóstico del tumor. Los inconvenientes son el neumotórax que ocurre en el 15 al 55%, a veces muy graves o la diseminación pleural de células tumorales. Las contraindicaciones son enfisema bulloso, sospecha de quiste hidatídico, sospecha de aneurisma o fístula arteriovenosa, neumonectomía contralateral, diátesis hemorrágica y cor pulmonale grave.
Mediastinoscopia
Está encaminada a la visualización del mediastino anterior. Se realiza una incisión paraesternal y se extirpa de 1 a 1,5 cm de cartílago costal, entrando en mediastino anterior y pudiendo llegar al hilio pulmonar. Nos permite la visualización directa de los ganglios hiliares contralaterales y la toma de biopsia, que si son positivos será contraindicación quirúrgica. Esta técnica cada vez se realiza menos debido al empleo de la TAC ya que la existencia de adenopatías visibles con TAC, aumenta la sospecha de infiltración linfática, pero no nos aporta datos sobre las características histológicas de los ganglios mediastínicos. Constituye una exploración quirúrgica obligada ante la sospecha clínico-radiológica de adenopatías. La mayoría de los cánceres pulmonares la afectación ganglionar mediastínica supone una contraindicación quirúrgica para la mayoría de los cirujanos, sobre todo si hay una invasión extracapsular del tumor (desborda la cápsula del ganglio e infiltra tejidos vecinos). Únicamente en el cáncer epidermoide se ha observado una buena supervivencia a los cinco años, asociando, en estos casos, la radioterapia al tratamiento quirúrgico. Resumiendo, podemos decir que la mediastinoscopia evita muchas toracotomías innecesarias. Por ello, para asegurar o descartar la afectación mediastínica se deberá practicar una mediastinoscopia que recoja muestras de los ganglios traqueobronquiales, paratraqueales bilaterales y subcarínicos, pues existe la posibilidad de diseminación cruzada. Igualmente, se obtendrán muestras del tejido graso mediastínico para descartar la invasión directa del tumor. La existencia de metástasis hematógenas a cualquier nivel descarta cualquier tipo de intervención quirúrgica sobre el tumor primitivo. En cuanto a las metástasis linfáticas, sólo serán excluyentes de cirugía si corresponden a un territorio que no pueda ser extirpado en el mismo acto quirúrgico que el de la extirpación de la lesión original, o bien cuando la infiltración sea tal que se encuentre afectada la cápsula ganglionar. En este último caso, la existencia de afectación capsular significa de hecho la existencia de infiltración del mediastino.
Isótopos radiactivos
- Estudio de la perfusión pulmonar se emplean macroagregados de albúmina marcada con I131 o Tecnecio 99. Habitualmente, el déficit de perfusión que se observa en la gammagrafía es mayor del que se podía presumir por las radiografías, sobre todo en los tumores situados en el segmento posterior del lóbulo superior; esta discrepancia puede interpretarse como consecuencia de la compresión directa de la arteria pulmonar por el tumor o adenopatías, y del reflejo de von Euler-Liljestrand, que determina un descenso de la perfusión a consecuencia de la obstrucción bronquial. Se realiza con poca frecuencia para valorar la función pulmonar que determine la tolerancia del paciente a una eventual cirugía o radioterapia.
- Gammagrafía con Galio 67: la detección de metástasis, sobre todo ganglionares se realiza con bleomicina marcada con Co57 o con Ga67. Pretendía ser una técnica incruenta que sustituyese a la mediastinoscopia o que sirviese al menos como método previo de selección de candidatos a la mediastinoscopia. No ha resultado así por su escasa sensibilidad y por la abundancia de falsos positivos y negativos. No es por tanto, técnica de gran utilidad en el diagnóstico de extensión.
- Tomografía por Emisión de Positrones (PET): utiliza glucosa marcada con un átomo radiactivo. Las células cancerosas del cuerpo absorben grandes cantidades de azúcar radiactiva, y una cámara especial puede detectar la radiactividad. Ésta es una prueba muy importante en los casos de cáncer del pulmón en etapas tempranas. El médico solicitará esta prueba para ver si el cáncer se ha propagado a los ganglios linfáticos. También es útil para determinar si una imagen o nódulo pulmónar que aparece en las radiografías de tórax es cáncer. Los exámenes de PET son útiles cuando el médico piensa que el cáncer de pulmón se ha propagado, pero no se sabe dónde. Los exámenes de PET se pueden usar en lugar de varias pruebas de imagen radiológicas diferentes debido a que exploran todo el cuerpo.
Estudio de la extensión intratorácica
Puede tener dos objetivos: valorar las posibilidades quirúrgicas de un tumor que endoscópicamente es resecable y ante un tumor ya irresecable, poder evaluar con más exactitud la respuesta terapéutica. Los métodos exploratorios a utilizar son:
- TAC torácico:
- RMN torácica.
- Mediastinoscopia:
- PET.
- PET-TAC de fusión, muy útil para planificar una cirugía o una radioterapia radical.
Otras técnicas no tienen un carácter de aplicación tan general como las referidas y quedan restringidas a la presencia de determinados síntomas o signos. Deberán realizarse según los casos:
- Esofagograma con bario: el tránsito baritado se hace ante la sospecha de compresión o infiltración esofágica que clínicamente se manifiesta con disfagia y ante la sospecha de fístula esofagobronquial (en este caso se emplea contraste yodado hidrosoluble). Se debe completar con esofagoscopia.
- Endoscopia digestiva: tiene las mismas indicaciones que el tránsito baritado esofágico. Permite ver la infiltración del esófago por el tumor.
- Biopsia de adenopatías cervicales, axilares o supraclaviculares o bien biopsia de grasa preescalénica en caso de induración supraclavicular o en tumor de Pancoast.
- Citologías seriadas de líquido pleural, completadas en caso de dudas con la biopsia pleural ciega o por pleuroscopia.
- Ecografía: se utiliza para el estudio de derrames pleurales. En el cáncer pulmonar no da resultados diferenciados. Es muy útil la ecografía hepática cuando se sospechan metástasis hepáticas.
Estudio de la extensión extratorácica
Se realizará con vistas a la detección de metástasis cuando exista sospecha clínica, exploratoria o analítica. Dependiendo del órgano o tejido supuestamente afectado se realizará:
- Sospecha de metástasis óseas: radiología o gammagrafía ósea o biopsia de cresta ilíaca
- Gammagrafía ósea: se realizará cuando aparece dolor óseo en el cáncer de pulmón, sobre todo adenocarcinoma. Si esta exploración demuestra captaciones patológicas del isótopo, se procederá a su confirmación con estudios radiológicos selectivos de la zona afecta, e incluso se llegará a la punción biopsia de la zona, para descartar o confirmar el diagnóstico de la lesión.
- Radiología simple de las lesiones óseas sospechosas detectadas por gammagrafía o por la presencia de síntomas.
- Biopsia de cresta ilíaca: Se realizará en los pacientes portadores de un carcinoma anaplásico de células pequeñas con el fin de estudiar la médula ósea, frecuentemente afectada por invasión tumoral en este tipo histológico.
- Sospecha de afectación hepática: ecografía hepática o TAC abdominal o laparoscopia con biopsia. A la vez se intentará descartar las metástasis en las glándulas suprarrenales.
- Sospecha de afectación cerebral: citología de LCR o TAC cerebral. El TAC se utiliza en el diagnóstico de las metástasis cerebrales, que pueden presentarse sin sintomatología neurológica entre el 5 y el 10% de los carcinomas de pulmón. Un TAC de cráneo que muestre una o varias lesiones redondeadas que se intensifican mediante el contraste, rodeadas de edema, en un paciente con cáncer de pulmón, suele ser suficiente para el diagnóstico de metástasis cerebral.
Es preciso resaltar que aproximadamente 1/3 de los enfermos con carcinoma pulmonar presentan metástasis a distancia en el momento del diagnóstico (exceptuando el oat-cell, en el que la incidencia es mayor). Por consiguiente, su búsqueda es obligatoria antes de someter al enfermo a una toracotomía y resección innecesarias.
Pruebas complementarias generales
Se deben realizar a todos los pacientes para determinar el estado general del paciente:
- Historia clínica y exploración física completas: determinan el estado general y la pérdida de peso del paciente.
- Hemograma: recuento hemático completo, con determinación de las plaquetas.
- Bioquímica completa: electrólitos, glucosa, calcio y fósforo séricos y función hepática y renal. La alteración de las enzimas hepáticas nos hará sospechar la presencia de metástasis en el hígado. Son muy importantes la albúmina y la LDH.
- Electrocardiograma
- Pruebas de función pulmonar como la Espirometría y la Gasometría(determinación de gases en la sangre arterial). Los parámetros límite para una neumectomía son: Capacidad vital < 45%.VEMS<800 ml. pCO2>45 mmHg.
- Pruebas de coagulación.
- Marcadores tumorales: como el antígeno carcinoembrionario (CEA) aumentado que sirve para el seguimiento clínico y alfafetoproteína (AFP): cuando existen metástasis hepáticas.
Determinación del estadio
Por muchas razones, sobre todo para comparar los resultados del tratamiento es de gran utilidad la existencia de un método uniforme TNM para la determinación del estadio del cáncer en función de su extensión anatómica en el momento del diagnóstico. TUMOR PRIMARIO (T):
- T0 - No hay signos de un tumor primario.
- TX - Cáncer oculto, demostrado en la citología del lavado bronquial pero no radiológicamente ni en la fibrobroncoscopia. Las secreciones broncopulmonares contienen células malignas pero no hay otros datos de la existencia de un cáncer de pulmón.
- TIS - Carcinoma in situ
- T1 - Tumor menor o igual de 3 cm de dimensión máxima, rodeado por tejido pulmonar o pleural visceral y sin invasión proximal al bronquio lobar en la fibrobroncoscopia. También se clasifican en T1 los tumores poco frecuentes, superficiales, de cualquier tamaño, con invasión limitada a la pared bronquial que se extienden proximalmente al bronquio principal.
- T2 - Tumor mayor de 3 centímetros de dimensión mayor o tumor de cualquier tamaño que invade la pleura visceral o con atelectasia o neumonitis obstructiva que se extiende a la región hiliar. En la broncoscopia, la extensión proximal del tumor puede limitarse al bronquio lobar o estar al menos a 2 cm de la carina. La atelectasia o la neumonitis obstructiva no deben afectar a todo un pulmón.
- T3 - Tumor de cualquier tamaño con extensión directa a la pared costal (incluidos los tumores de la cisura superior) diafragma, pleura mediastínica o pericardio, sin afectación del corazón, grandes vasos, tráquea, esófago, cuerpos vertebrales o un tumor del bronquio principal a menos de 2 cm de la carina, sin infiltración de la misma. La atelectasia afecta a todo un pulmón. Existe derrame pleural no maligno.
- T4 - Tumor de cualquier tamaño con infiltración del mediastino o del corazón, grandes vasos, tráquea, esófago, cuerpos vertebrales o carina o con derrame pleural maligno. Los derrames pleurales no hemáticos ni exudativos y con varios estudios citológicos negativos no se clasifican como malignos con fines de determinación del estadio.
Ganglios linfáticos regionales (N):
- N0 - Sin metástasis demostrables en los ganglios linfáticos
- N1 - Metástasis en los ganglios linfáticos peribronquiales o hiliares ipsolaterales, o ambos, incluyendo la extensión directa del tumor.
- N2 - Metástasis en los ganglios mediastínicos o subcarínicos ipsolaterales.
- N3 - Metástasis en los ganglios mediastínicos o hiliares contralaterales, escalénico ipso o contralateral o supraclaviculares.
. Metástasis a distancia (M):
- M0 - Sin metástasis a distancia conocidas.
- M1 - Metástasis a distancia presentes, especificando su localización por ejemplo en cerebro.
Estadificación del cáncer de pulmón
- Carcinoma oculto
- TX
- N0
- M0
- Estadio 0
- TIS
- Carcinoma in situ
- Estadio I
- IAT1 N0 M0
- IB T2 N0 M0
- Estadio II
- IIAT1 N1 M0
- IIB T2 N1 M0/T3 N0 M0
- Estadio IIIa
- T3 (ó T1 ó T2 con N2)
- N0, N1 ó N2
- M0
- Estadio IIIb
- Cualquier T
- N3 ( ó cualquier N con T4)
- M0
- Estadio IV.
- Cualquier T
- Cualquier N
- M1.
La International Association for the Study of Lung Cancer clasifica el cáncer microcítico de pulmón, solamente en dos estadios: enfermedad localizada al tórax y enfermedad diseminada fuera del tórax.
Tratamiento del cáncer de pulmón
Las opciones de tratamiento para el cáncer de pulmón son cirugía, radioterapia y quimioterapia, solas o combinadas, dependiendo según el estado del cáncer, el tipo celular del cáncer y que tanto se ha diseminado, así como el estado de salud del paciente.[1] Por esta razón, es muy importante que se realicen todas las pruebas diagnósticas necesarias para determinar el estadio del cáncer.
Es importante que el paciente dedique tiempo para pensar sobre todas las opciones posibles. Otros factores que hay que considerar incluyen los posibles efectos secundarios del tratamiento; y las probabilidades de curación de la enfermedad, de prolongación de la vida o de alivio de los síntomas.
Cirugía
Si las investigaciones diagnósticas confirman la presencia de cáncer de pulmón, una tomografía puede determinar si la enfermedad está localizada y si es posible el abordaje quirúrgico o si la diseminación es tal que no puede ser curada con cirugía. También se espera que se hagan exámenes de sangre y de función pulmonar para determinar si el paciente está en condiciones de ser operado y si le quedará suficiente tejido pulmonar sano después de la cirugía. Si se descubre una reserva respiratoria deficiente, como en el caso de fumadores con enfermedad pulmonar obstructiva crónica, puede que la cirugía esté contraindicada.
Algunos procedimientos quirúrgicos incluyen:
- Si se extirpa un lóbulo del pulmón, el procedimiento se llama lobectomía.[76]
- Si se extirpa todo el pulmón, la cirugía se denomina neumonectomía.[76]
- La extirpación de parte de un lóbulo se conoce como segmentectomía o resección en cuña.[76]
Estas operaciones requieren la administración de anestesia general y una incisión en el tórax, llamada toracotomía. En aquellos pacientes con una reserva respiratoria adecuada, la lobectomía es el abordaje preferido por razón de que minimiza la probabilidad de una recurrencia localizada. Si las funciones pulmonares del paciente son bajas, se aconseja una resección en cuña.[77]
Generalmente la estancia hospitalaria es de una a dos semanas. Las posibles complicaciones incluyen hemorragia importante, infección de las heridas y neumonía. Debido a que el cirujano debe realizar el corte a través de las costillas para llegar al pulmón, las costillas dolerán por un tiempo después de la cirugía. Las actividades se limitan durante al menos uno o dos meses.
Si los pulmones están en buenas condiciones (además de la presencia del cáncer), usualmente se pueden reanudar las actividades normales después de la extirpación de un lóbulo o hasta después de la extirpación de todo el pulmón. Sin embargo, si los pulmones están dañados y el paciente tiene enfermedades no cancerosas tales como enfisema o bronquitis crónica (que son enfermedades comunes entre los grandes fumadores), es posible que se experimente dificultad para respirar después de la cirugía.
Si no se puede someter a una toracotomía debido a una enfermedad pulmonar u otros problemas médicos graves, o si el cáncer se ha extendido, se pueden utilizar otros tipos de cirugía para aliviar algunos síntomas. Por ejemplo, se puede utilizar cirugía con láser para aliviar una obstrucción de las vías aéreas que pueda estar causando neumonía o dificultad para respirar.
Si el cáncer del pulmón se ha propagado al cerebro, es posible que la extirpación de la metástasis cerebral (metastasectomía) sea beneficiosa. Es necesario realizar una craneotomía (cirugía a través de un orificio en el cráneo). Este tipo de cirugía sólo se debe realizar si el tumor se puede extirpar sin causar daños al cerebro.
Recientemente, se ha estado desarrollando un procedimiento menos invasivo para tratar el cáncer del pulmón en etapa temprana. Una cámara diminuta se coloca dentro de la cavidad del tórax para permitir que el cirujano vea el tumor (toracoscopia). Sólo se necesitan pequeñas incisiones, por lo que el paciente siente menos dolor después de la cirugía. La mayoría de los expertos recomiendan que este procedimiento se utilice únicamente en pacientes cuyos tumores miden menos de cuatro a cinco centímetros. La tasa de curación después de la cirugía parece ser la misma en comparación con otras técnicas. Sin embargo, es importante que el cirujano tenga experiencia llevando a cabo este procedimiento ya que el mismo requiere más destrezas técnicas que la cirugía estándar.
La cirugía de pulmón tiene una tasa de muerte post-operatoria cercana de 4,4%, dependiendo de la función pulmonar y otros factores de riesgos.[78]
Criterios de irresecabilidad
Se entiende por resecabilidad la posibilidad de extirpación quirúrgica de todo el tejido tumoral. La presentación de tumores intratorácicos extrapulmonares son contraindicación quirúrgica absoluta porque son irresecables. La función de los criterios de irresecabilidad es precisar las contraindicaciones quirúrgicas, operando tan sólo a los pacientes a los que se les puede resecar completamente el tumor evitando las toracotomías inútiles. Un cáncer de pulmón es irresecable cuando presenta:
- Metástasis a distancia: se incluye en este concepto, además de la afectación de diferentes órganos y estructuras , bien sea más de uno a la vez o un solo órgano con extensión tumoral difusa[79](hígado, hueso, cerebro, suprarrenales, piel, etc.), la infiltración de la grasa pre-escalénica supraclavicular (el tejido adiposo ubicado en la profundidad de la región supraclavicular, delante de los músculos escalenos), la afectación de adenopatías cervicales o de otro territorio ganglionar fuera del mediastino (supraclaviculares) o el Síndrome de Horner.[80]
- Afectación ganglionar mediastínica contralateral hiliares contralaterales y ganglios subcarinales o intertraqueobronquiales, paratraqueales altas o prevasculares.
- Afectación ganglionar mediastínica homolateral si se demuestra infiltración periganglionar. Las adenopatías hiliares del mismo lado del tumor, si es un tumor muy diferenciado no es contraindicación quirúrgica, pero esto está en función de la agresividad del equipo quirúrgico.
- Invasión del nervio frénico: para algunos cirujanos es contraindicación relativa.
- Invasión del pericardio: para algunos cirujanos es contraindicación relativa en el caso del cáncer epidermoide.
- Invasión del nervio laríngeo recurrente.
- Síndrome de la vena cava superior o de la inferior,[80] ya sea por infiltración o compresión o las dos a la vez. Aquí la radioterapia tiene indicación urgente.
- Invasión del esófago.
- Compromiso de ambos lóbulos hepáticos.[81]
- Invasión del conducto torácico.
- Afectación del bronquio principal a menos de 2 cm de la carina o bifurcación traqueal o afectación de la traquea o carina.
- Afectación extensa de la pared torácica o derrame pleural[82] conteniendo células neoplásicas (decubiertas por citología o biopsia positiva), metastásico o hemorrágico.
- La variedad histológica oat-cell. Últimamente este criterio se está reconsiderando en caso de tumor pequeño periférico, combinando la resección con quimioterapia y radioterapia. El oat cell carcinoma es inoperable. Los resultados del tratamiento quirúrgico demuestran que la supervivencia a los 5 años es similar con radioterapia. La tendencia actual es a no operar y realizar tratamiento con radioterapia cuando nos encontramos con este tipo anatomopatológico. Algunas escuelas someten a cirugía el tumor microcítico en estadio T1N0M0 pero es raro encontrarlo en este estadio. El que esté contraindicado el tratamiento quirúrgico en el carcinoma de células pequeñas no quiere decir que no se pueda hacer cirugía paliativa.
- Cualquier estadio T4. Suelen tener una escala de rendimiento de Karnofsky menor del 50%,[80] indicando que su capacidad de realizar tareas reducidas está reducida a un 50%.
Criterios de inoperabilidad
Se establecen en función de la situación clínico-funcional del enfermo: situación en que se encuentra antes de la intervención, y posibilidad de soportar funcionalmente el grado de resección pulmonar que en cada caso se precise.
- Según las características generales del sujeto:
- Edad cronológica avanzada. Se establece normalmente en personas mayores de 75-80 años.
- Enfermedad cardiovascular importante: infarto agudo de miocardio reciente (de menos de 3-6 meses de evolución), arritmias, hipertensión maligna, insuficiencia cardiaca refractaria, accidente cerebrovascular agudo.
- Enfermedad grave asociada no controlable: coagulopatías, insuficiencia renal en hemodiálisis, cirrosis, diabetes evolucionada.
- Malnutrición.
- Según la función respiratoria:
- VEMS preoperatorio inferior a 1 L, o inferior al 50% del teórico. Con VEMS entre 1 y 2 litros mejorará con broncodilatadores y dejar de fumar. Con FEV1 o VEMS>2 L no hay problema.
- VEMS postoperatorio calculado inferior a 8 dL; La resección impediría al paciente llevar una actividad física normal, porque tendría disnea de reposo.
- Capacidad vital inferior al 45-50%.
- Difusión inferior al 50%.
- Paciente con enfisema, bronquitis crónica, con patrón radiológico obstructivo, restrictivo o mixto y capacidad funcional disminuida.
- Insuficiencia respiratoria: pO2<60 mmHg y pCO2> 45 mmHg.
En situaciones límite deberá realizarse, por un lado, estudio funcional con xenón midiendo porcentajes de ventilación y perfusión en cada pulmón por separado e incluso cateterismo derecho. Por otro, valoración de la posibilidad de intervención en función de estos datos y de la resección que deba realizarse para extirpar la tumoración.
Radioterapia
La radioterapia utiliza rayos X de alta energía para destruir las células cancerosas.
En la radioterapia externa se utiliza radioterapia generada en el exterior del cuerpo por medio de un acelerador lineal y que se concentra en el cáncer. Este tipo de radioterapia es el que se usa con más frecuencia para tratar un cáncer primario del pulmón o sus metástasis en otros órganos.[76]
En la radioterapia interna o braquiterapia se utilizan pequeñas pastillas de material o isótopo radiactivo que se colocan directamente en el área cancerosa o en la vía aérea próxima al área cancerosa.[76] Este tipo de braquiterapia generalmente es de tipo paliativo y su principal indicación es una atelectasia obstructiva por el cáncer. La braquiterapia en los márgenes de la resección puede reducir la recurrencia.[83]
Algunas veces se usa la radioterapia como el tratamiento principal (primario) del cáncer del pulmón, especialmente cuando la salud general del paciente es demasiado pobre como para someterse a una cirugía. También se puede usar la braquiterapia para ayudar a aliviar el bloqueo de las grandes vías aéreas causado por el cáncer.
Se puede usar la radioterapia después de la cirugía para destruir restos muy pequeños de cáncer que no se pueden ver ni extirpar durante la cirugía (enfermedad microscópica residual). Además, la radioterapia se puede usar para aliviar algunos síntomas de cáncer del pulmón como dolor, hemorragia, dificultad para tragar (disfagia), y problemas causados por las metástasis cerebrales.
Los efectos secundarios de la radioterapia pueden incluir problemas leves en la piel, náuseas, vómitos y cansancio. Frecuentemente estos efectos secundarios duran un corto espacio de tiempo. La radioterapia también puede empeorar los efectos de la quimioterapia. La radioterapia en el tórax puede dañar los pulmones y causar dificultad para respirar. El esófago se encuentra en el centro del tórax y estará expuesto a la radioterapia. Por esta razón, es posible que se experimente dificultad para tragar durante el tratamiento (esofagitis). Estos efectos mejorarán después de finalizar el tratamiento.
La radioterapia en grandes áreas del cerebro (radioterapia holocraneal) algunas veces puede alterar la función cerebral. Es posible que se experimente pérdida de la memoria, dolor de cabeza, dificultad para pensar o disminución del deseo sexual. Normalmente estos síntomas son menores si se comparan con aquellos causados por un tumor cerebral; sin embargo, pueden reducir la calidad de la vida. Los efectos secundarios de la radioterapia en el cerebro generalmente se vuelven más graves uno o dos años después del tratamiento. Cuando existe menos de tres metástasis cerebrales se puede intentar una técnica radioterápica llamada radiocirugía, en la que se administra alta dosis de radioterapia sobre la lesión metastásica en una sola sesión.
Quimioterapia
La quimioterapia es un tratamiento en el cual se administran medicamentos antineoplásicos o citostáticos contra el cáncer por vía intravenosa u oral. Estos medicamentos entran en el torrente sanguíneo y llegan a todas las áreas del cuerpo, lo cual permite que este tratamiento sea útil para aquellos cánceres que se han propagado o metastatizado en órganos distantes del pulmón. Dependiendo del tipo y del estadio del cáncer del pulmón, la quimioterapia se puede administrar como tratamiento principal (primario) o como tratamiento auxiliar (adyuvante) a la cirugía o la radioterapia. Generalmente en la quimioterapia para el cáncer del pulmón se utiliza una combinación de medicamentos contra el cáncer (poliquimioterapia).
El cisplatino (CDDP), o su similar, el carboplatino, son los agentes quimioterápicos que se usan con más frecuencia para tratar el cáncer del pulmón de células no pequeñas (NSCLC).[84] Estudios recientes han encontrado que la combinación de cualquiera de estos con medicamentos como gemcitabina, paclitaxel, docetaxel, etopósido (VP-16), o vinorelbina parece mejorar la eficacia en el tratamiento del NSCLC.[85] La gemcitabina se aprobó inicialmente para el tratamiento del cáncer de páncreas y es ahora ampliamente usado en el tratamiento del NSCLC. La vinorelbina es un alcaloide que inhibe la mitosis en células en la fase M del ciclo celular al inhibir la polimerización de la tubulina. La mielosupresión, es decir, una reducción en la producción de la línea granulocítica de los glóbulos blancos es el único efecto adverso que limita la dosificación de estos medicamentos.[19] Se continúa investigando en estudios clínicos la mejor manera de utilizar esta combinación de medicamentos.
Algunas de las combinaciones usuales de medicamentos en la quimioterapia utilizada para pacientes con cáncer del pulmón de células pequeñas (SCLC) incluyen:[73]
- EP (etopósido y cisplatino)
- ET (etopósido y carboplatino)
- ICE (ifosfamida, carboplatino y etopósido)
- CAV (ciclofosfamida, doxorubicina o adriamicina y vincristina).
Los nuevos medicamentos como gemcitabina, paclitaxel, vinorelbina, topotecan y tenipósido han mostrado resultados prometedores en algunos estudios de SCLC.[86][87] Si la salud del paciente es relativamente buena, es posible que se administren dosis más altas de quimioterapia junto con medicamentos denominados factores de crecimiento (factor estimulante de colonias de neutrófilos o macrófagos y eritropoyetina). Estos ayudan a prevenir los efectos secundarios de la quimioterapia en la médula ósea.
Los medicamentos de la quimioterapia destruyen las células cancerosas pero también dañan algunas células normales. Por lo tanto, los médicos tienen mucho cuidado para evitar o minimizar los efectos secundarios. Los efectos secundarios de la quimioterapia dependen del tipo de medicamentos que se usen, la cantidad que se administre y la duración del tratamiento. Los efectos secundarios temporales pueden incluir náuseas y vómitos, pérdida del apetito (anorexia), pérdida del cabello (alopecia) y aparición de llagas en la boca (mucositis).
Debido a que la quimioterapia puede dañar las células hematopoyéticas de la médula ósea, es posible que presenten recuentos bajos de células sanguíneas (citopenias). Esto puede aumentar el riesgo de sufrir infecciones (debido a una escasez de glóbulos blancos: leucopenia y neutropenia), sangrado o aparición de hematomas después de heridas o lesiones menores (debido a una escasez de plaquetas en la sangre: trombocitopenia), y cansancio o falta de respiración (debido a un recuento bajo de glóbulos rojos: anemia). Ya que el cisplatino, vinorelbina, docetaxel o paclitaxel pueden dañar los nervios, es posible que se experimente adormecimiento, particularmente en los dedos de las manos y los pies, y algunas veces debilidad en los brazos y piernas (neuropatía).
Algunos de los efectos secundarios desaparecen unos días después del tratamiento. Existen varios remedios para muchos de estos efectos secundarios temporales de la quimioterapia. Por ejemplo, el médico puede recetar medicamentos antieméticos para prevenir o reducir las náuseas y los vómitos. Algunos estudios han sugerido que los cannabinoides derivados de la marijuana usados durante la quimioterapia ha reducido la nausea y vómitos asociados al tratamiento permitiendo al paciente comer.[88]
Opciones de tratamiento por estadio y tipo de cáncer de pulmón
Cáncer del pulmón de células no pequeñas (NSCLC)
- Etapa 0: debido a que el cáncer de pulmón en etapa 0 están limitados al epitelio que recubre las vías aéreas y no han invadido el tejido pulmonar adyacente, se pueden curar sólo con cirugía, en un procedimiento llamado resección en cuña (extirpación quirúrgica de segmentos definidos o cuñas pequeñas).[89] Algunas veces es necesario extirpar el pulmón completo del lado afectado. Por lo general, no se necesita administrar quimioterapia ni radiación.
La terapia endoscópica fotodinámica puede representar una alternativa para la etapa 0 del cáncer de pulmón. La destrucción de las células cancerosas ocurre al sensibilizarlas con un medicamento inyectado, y activando esta substancia al dirigir un rayo láser directamente en el área cancerosa.[76] Si la etapa del cáncer es realmente la etapa 0, el tratamiento probablemente será curativo.
Etapa I: si el NSCLC está en etapa I y el tumor es pequeño, probablemente el tratamiento será sólo la extirpación quirúrgica del tumor mediante una lobectomía (extirpación de un lóbulo), o una cirugía menos extensa como por ejemplo segmentectomía o resección en cuña. Se ha reportado que la quimioterapia adicional (adyuvante) después de la cirugía para el NSCLC puede prevenir el regreso del cáncer de pulmón extirpado.[89] La tasa de supervivencia de 5 años esperada será de aproximadamente un 60 a un 80%. Si el paciente tiene problemas médicos graves, es posible que reciba sólo radioterapia como tratamiento principal.
Etapa II: si el NSCLC está en etapa II, el cáncer se extirpará quirúrgicamente mediante una lobectomía o mediante una cirugía menos extensa, como por ejemplo una segmentectomía. Si el paciente no puede tolerar una lobectomía, se puede realizar una resección en cuña. Después de la cirugía por lo general se utiliza la radioterapia para destruir las células cancerosas remanentes después de la cirugía, especialmente si estas células están presentes en el borde del tejido extirpado. Aunque los bordes de la muestra no presenten células cancerosas detectables, algunos médicos pueden recomendar radioterapia o quimioterapia adyuvante.[89] La tasa de supervivencia de 5 años esperada es de aproximadamente un 35% si se somete a una cirugía.
Etapa IIIA: si el NSCLC está en etapa IIIA, el tratamiento dependerá de la ubicación del cáncer en el pulmón y de los ganglios linfáticos a los cuales se haya propagado.
Se puede usar sólo cirugía, si el cirujano piensa que todo el cáncer se puede extirpar satisfactoriamente. Frecuentemente después de la cirugía se administra radioterapia, algunas veces junto con quimioterapia. Algunos estudios recomiendan que antes de la cirugía se administre quimioterapia o radioterapia, o ambos tratamientos, con el objetivo de disminuir el tamaño tumoral lo suficientemente como para que se pueda extirpar completamente durante la cirugía.[89] Algunas veces se usa la braquiterapia, en la que se pasa un rayo láser a través de un broncoscopio para destruir parte del cáncer dentro de la vía aérea.
Si no se somete a una cirugía debido a que el paciente padece otras enfermedades médicas graves que se lo impidan, se tratará el cáncer con radioterapia sola o combinada con quimioterapia adicional. Se están realizando varios estudios cuyo objetivo es determinar el mejor tratamiento para las personas con cáncer del pulmón en esta etapa.
Las tasas medias de supervivencia de cinco años varían entre un 10 a un 20%, pero algunos pacientes con cáncer en etapa IIIA pueden tener un mejor pronóstico.
Etapa IIIB: el NSCLC en etapa IIIB se ha propagado muy extensamente para poderse extirpar mediante cirugía. La tasa global de supervivencia de cinco años es aproximadamente de un 5%, pero si la salud del paciente es relativamente buena es posible que reciba beneficios de una combinación de quimio y radioterapia. En algunos casos, es posible realizar una cirugía después del tratamiento con quimioterapia o radioterapia. Se están realizando varios estudios cuyo objetivo es determinar el mejor tratamiento para las personas con cáncer del pulmón en esta etapa.
Etapa IV: debido a que el NSCLC se ha propagado a órganos distantes, la curación no es posible. Si se utiliza alguna terapia agresiva, el objetivo del tratamiento debe ser clara para el paciente y su familia. Si de otra manera la salud del paciente es buena, la quimioterapia puede ayudar a prolongarle la vida, aunque no ofrezca curación. Si el cáncer bloquea una vía aérea, se puede dar tratamiento con braquiterapia o con rayo láser a través de un broncoscopio para destruir parte del cáncer presente en la vía aérea. La radioerapia externa también puede usarse para tratar las complicaciones del cáncer en los pulmones, así como problemas derivados del crecimiento metastático como por ejemplo dolor de huesos y síntomas del sistema nervioso.
Varios estudios han mostrado que la quimioterapia puede prolongar la vida en casos de cáncer del pulmón en etapa IV. También puede aumentar la calidad de vida, aunque produzca efectos secundarios. Sólo de un 20% a un 25% de las personas que padecen cáncer del pulmón en etapa IV sobreviven 1 año, y cerca del 1% sobrevive 5 años.[6]
Si el paciente padece cáncer extenso o su salud es mala, es posible que desee considerar un tratamiento paliativo, quizá en el contexto de un buen programa hospitalario y de atención primaria. A muchos pacientes que padecen cáncer del pulmón les preocupa el dolor. Conforme el cáncer crece alrededor de ciertos nervios puede causar un dolor intenso. Sin embargo, es posible aliviar eficazmente el dolor con medicamentos, incluyendo la radioterapia.
Si el paciente ha sido tratatado con quimioterapia y no le está surtiendo efecto, tal vez también desee considerar atención paliativa. Una segunda clase de quimioterapia (segunda línea) puede proporcionar beneficios a los pacientes con cáncer del pulmón. Sin embargo, frecuentemente estos beneficios son muy breves y los efectos secundarios asociados son importantes. Si el paciente padece un cáncer incurable de pulmón debe tratar de aprovechar al máximo su vida y disfrutar cada día que pasa. Esto significa estar tan libre de síntomas como sea posible. Si el paciente desea continuar el tratamiento contra el cáncer, tal vez desee considerar participar en un ensayo clínico de medicamentos nuevos para quimioterapia u otros tratamientos nuevos como inhibidores de la angiogénesis (formación de nuevos vasos sanguíneos), o inhibidores de la transducción de señales (sustancias que interfieren con la acción de los factores de crecimiento), inmunoterapia o terapia genética.
Cáncer del pulmón de células pequeñas (SCLC)
El cáncer del pulmón de células pequeñas normalmente se clasifica como limitado o extendido. Por lo general, este tipo de cáncer de pulmón ya se ha propagado para el momento en que se diagnostica,[90] aunque no sea evidente por radiografía, de manera que se espera que el SCLC no se pueda curar sólo con cirugía.
- Etapa limitada
El tratamiento más comúnmente usado para el SCLC de etapa limitada es una combinación de dos o más medicamentos de quimioterapia, habitualmente el cisplatino o carboplatino combinado con etopósido, normalmente administrados durante aproximadamente seis meses. Es posible que la adición de topotecan o paclitaxel mejore la supervivencia.[89] Para el cáncer de células pequeñas con probabilidad de cura, a menudo se recomienda la radioterapia de tórax adicional a la quimioterapia, en especial porque el SCLC tiende a ser hiliar, es decir, a no ser periférica, concentrandose en el centro del tórax.[90] Es de esperar que se presenten más efectos secundarios con una terapia combinada, tales como dificultad para respirar y para tragar.
La radioterapia torácica no se realiza en aquellos pacientes que padecen una enfermedad pulmonar grave y otros trastornos severos adicionales al cáncer de pulmón. Algunas veces, si el SCLC está muy localizado, el cáncer se extirpa mediante cirugía y posteriormente se administra una quimioterapia adyuvante de combinación (poliquimioterpia). Si se le trata con quimioterapia, con o sin radioterapia, es posible que el tumor disminuya de tamaño y que comience una remisión. Sin embargo, tarde o temprano el cáncer volverá a crecer otra vez.[89]
El SCLC comúnmente se propaga al cerebro incluyendo en pacientes que han recibido radioterapia torácica. Por esta razón, si hay una buena respuesta al tratamiento inicial, es posible que se administre irradiación craneal profiláctica para reducir el riesgo de una metástasis cerebral, aumentando también la probabilidad de una mayor supervivencia.[90] La administración de radiación preventiva del cerebro ha dado como resultado ventajas en la supervivencia en general, de acuerdo con una reciente revisión de varios estudios recopilados. Se esperan efectos secundarios como pérdida de memoria y torpeza, con la radiación craneal como resultado directo de la radiación.
La tasa de supervivencia del primer año para las personas con SCLC en etapa limitada que reciben tratamiento con quimioterapia y radioterapia (éste es el grupo más favorable) es de un 60%. A los dos años la tasa disminuye a un 30%, y a los 5 años disminuye de un 10 a un 15%.[90] Debido a la carencia de resultados satisfactorios, los médicos están estudiando otros métodos para tratar estos cánceres. Los estudios clínicos de nuevos medicamentos de quimioterapia o de otros tratamientos nuevos tales como inmunoterapia o terapia genética, son una opción que vale la pena y que puede beneficiar tanto al paciente individual como a futuros pacientes.
- Etapa avanzada o diseminada
El SCLC en etapa avanzada puede ser manejada con quimioterapia—normalmente carboplatino o cisplatino junto con etopósido—permitiendo extender la esperanza de vida del paciente en un 70 a un 80%.[89] Eventualmente el cáncer se vuelve resistente al tratamiento, obligando al uso de otros medicamentos. La radioterapia puede controlar los síntomas del crecimiento dentro del pulmón o de la propagación a los huesos y al cerebro. Algunas veces se tratan con radioterapia preventiva en el cerebro.
Aproximadamente un 20 a un 30% de las personas que padecen SCLC en etapa avanzada viven 1 año. A los dos años, sólo un 5% permanecen vivos. Y sólo de 1 a 2 % de las personas con SCLC en etapa avanzada sobreviven cinco años después de la detección del cáncer.[89] Si el paciente está demasiado enfermo para tolerar la quimioterapia, el mejor plan es proporcionar cuidados paliativos: alivio del dolor, de problemas respiratorios y otros síntomas. Aunque padezca un cáncer incurable de pulmón el paciente debe tratar de aprovechar al máximo su vida, debe disfrutar cada día. Esto significa que debe estar tan libre de síntomas como sea posible. En los casos de cáncer del pulmón en etapa avanzada el principal problema puede ser el dolor.[89] El crecimiento del cáncer alrededor de ciertos nervios puede causar un intenso dolor. Sin embargo, este dolor puede aliviarse con medicamentos. La radioterapia también puede ser de utilidad. Tal vez desee participar en un ensayo clínico de nuevos medicamentos de quimioterapia u otros tratamientos nuevos como terapia antiangiogénica, inmunoterapia o terapia genética.[89]
Prevención del cáncer de pulmón
La prevención primaria a través de el abandono o del evitar el consumo de tabaco, junto con una detección temprana representan las medidas de control del cáncer de pulmón más importantes.[19] Los esfuerzos anti-tabáquicos comenzados desde los años 1970 han comenzado a traducirse en un aplanamiento de la incidencia de muerte por cáncer de pulmón en los varones blancos, en tanto que entre las mujeres la incidencia está todavía en aumento, porque cada día son más las mujeres fumadoras. No todas las causas de cáncer de pulmón son debido al fumar cigarrillos, pues el papel del fumador pasivo ha estado incrementando en importancia asociado a un factor riesgo de la aparición del cáncer de pulmón. Ello ha incentivado la creación de políticas para disminuir el contacto con el humo del cigarrillo entre no-fumadores. El humo proveniente de automóviles, industrias y plantas energéticas también suponen un riesgo de cáncer de pulmón.[12][14][91] Los complejos multivitamínicos tomados a largo plazo no ayudan a prevenir el cáncer de pulmón, mientras que la vitamina E parece aumentar el riesgo de cáncer de pulmón en fumadores.[69]
Referencias
- ↑ a b Minna, JD (2004). Harrison's Principles of Internal Medicine. McGraw-Hill. pp. 506-516. ISBN 0071391401. doi:10.1036/0071402357.
- ↑ Cancer de pulmón en vivirmejor.es
- ↑ Cancer de pulmón en vivirmejor.es
- ↑ a b c d e Vaporciyan, AA; Nesbitt JC, Lee JS et al. (2000). Cancer Medicine. B C Decker Inc. pp. 1227-1292. ISBN 1-55009-113-1.
- ↑ Cancer de pulmón en vivirmejor.es
- ↑ a b «Lung Carcinoma: Tumors of the Lungs». Merck Manual Professional Edition, Online edition. Consultado el 15 de agosto de 2007.
- ↑ Cancer de pulmón en vivirmejor.es
- ↑ Gorlova, OY; Weng SF, Zhang Y et al. (July 2007). «Aggregation of cancer among relatives of never-smoking lung cancer patients». International Journal of Cancer 121 (1): 111-118. PMID 17304511.
- ↑ Hackshaw, AK; Law MR, Wald NJ (October 1997). «The accumulated evidence on lung cancer and environmental tobacco smoke». British Medical Journal 315 (7114): 980-988. PMID 9365295. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ a b c Catelinois, O; Rogel A, Laurier D et al. (May 2006). «Lung Cancer Attributable to Indoor Radon Exposure in France: Impact of the Risk Models and Uncertainty Analysis». Environmental Health Perspectives (National Institute of Environmental Health Science) 114 (9): 1361-1366. PMID 16966089. doi:10.1289/ehp.9070. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ a b O'Reilly, KM; Mclaughlin AM, Beckett WS, Sime PJ (March 2007). «Asbestos-related lung disease». American Family Physician 75 (5): 683-688. PMID 17375514. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ a b Kabir, Z; Bennett K, Clancy L (February 2007). «Lung cancer and urban air-pollution in dublin: a temporal association?». Irish Medical Journal 100 (2): 367-369. PMID 17432813.
- ↑ Coyle, YM; Minahjuddin AT, Hynan LS, Minna JD (September 2006). «An ecological study of the association of metal air pollutants with lung cancer incidence in Texas.». Journal of Thoracic Oncology 1 (7): 654-661. PMID 17409932.
- ↑ a b Chiu, HF; Cheng MH, Tsai SS et al. (December 2006). «Outdoor air pollution and female lung cancer in Taiwan.». Inhalation Toxicology 18 (13): 1025-1031. PMID 16966302.
- ↑ U.S. Department of Health and Human Services. "The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General", 2006.
- ↑ WHO International Agency for Research on Cancer "Tobacco Smoke and Involuntary Smoking" IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 83, 2002.
- ↑ vivirmejor.es, ed. (octubre, 2007). «Sólo el 20% de los cánceres de pulmón se pueden operar». Consultado el 10 de julio de 2009.
- ↑ Pilar Garrido (febrero, 2004). El Mundo del Siglo XXI, ed. «¿Qué porcentaje de casos de cáncer de pulmón se cura?». Consultado el 10 de julio de 2009.
- ↑ a b c Katzung, Bertram G. (2007). «Chapter 55. Cancer Chemotherapy». Basic & Clinical Pharmacology (9 edición). McGraw-Hill. ISBN 0071451536.
- ↑ a b Asociación Española Contra el Cáncer, ed. (julio, 2007). «El cancer de pulmón en cifras, AECC». Consultado el 10 de julio de 2009.
- ↑ OMS (2004). «Deaths by cause, sex and mortality stratum» (PDF). World Health Organization. Consultado el 1 de junio de 2007.
- ↑ «Lung Cancer Facts (Women)». National Lung Cancer Partnership. 2006. Consultado el 26 de mayo de 2007.
- ↑ OMS (February 2006). «Cancer». Organización Mundial de la Salud. Consultado el 25 de junio de 2007.
- ↑ a b c d e f Travis, WD; Travis LB, Devesa SS (January 1995). «Lung cancer». Cancer 75 (Suppl. 1): 191-202. PMID 8000996.
- ↑ Morandi, U; Casali C, Rossi G (2006). «Bronchial typical carcinoid tumors». Seminars in Thoracic and Cardiovascular Surgery 18 (3): 191-198. PMID 17185178.
- ↑ Etienne-Mastroianni, B; Falchero L, Chalabreysse L et al. (December 2002). «Primary sarcomas of the lung: a clinicopathologic study of 12 cases». Lung Cancer 38 (3): 283-289. PMID 12445750.
- ↑ Sánchez-Mora, N; Parra-Blanco V, Cebollero-Presmanes M et al. (January 2007). «Mucoepidermoid tumors of the bronchus. Ultrastructural and immunohistochemical study». Histology and Histopathology 22 (1): 9-13. PMID 17128406.
- ↑ Moran, CA; Suster S, Koss MN (March 1994). «Primary adenoid cystic carcinoma of the lung. A clinicopathologic and immunohistochemical study of 16 cases». Cancer 73 (5): 1390-1397. PMID 7509254.
- ↑ Subramanian, J; Govindan R (February 2007). «Lung cancer in never smokers: a review». Journal of Clinical Oncology (American Society of Clinical Oncology) 25 (5): 561-570. PMID 17290066.
- ↑ Raz, DJ; He B, Rosell R, Jablons DM (March 2006). «Bronchioloalveolar carcinoma: a review». Clinical Lung Cancer (Cancer Information Group) 7 (5): 313-322. PMID 16640802.
- ↑ Veronesi G; Morandi U, Alloisio M et al. (July 2006). «Large cell neuroendocrine carcinoma of the lung: a retrospective analysis of 144 surgical cases». Lung Cancer 53 (1): 111-115. PMID 16697073. doi:10.1016/j.lungcan.2006.03.007.
- ↑ Collins, LG; Haines C, Perkel R, Enck RE (January 2007). «Lung cancer: diagnosis and management». American Family Physician (American Academy of Family Physicians) 75 (1): 56-63. PMID 17225705.
- ↑ Rosti, G; Bevilacqua G, Bidoli P et al. (March 2006). «Small cell lung cancer». Annals of Oncology 17 (Suppl. 2): 5-10. PMID 16608983. doi:10.1093/annonc/mdj910. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Barbone, F; Bovenzi M, Cavallieri F, Stanta G (December 1997). «Cigarette smoking and histologic type of lung cancer in men». Chest (PDF) (American College of Chest Physicians) 112 (6): 1474-1479. PMID 9404741. doi:10.1378/chest.112.6.1474. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Seo, JB; Im JG, Goo JM et al. (2001). «Atypical pulmonary metastases: spectrum of radiologic findings». Radiographics 21 (2): 403-417. PMID 11259704. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ «Commonly diagnosed cancers worldwide». Cancer Research UK. Apr 2005. Consultado el 11 de enero de 2008.
- ↑ Mohr, SB; Garland CF, Gorham ED et al. (2008). «Could ultraviolet B irradiance and vitamin D be associated with lower incidence rates of lung cancer?». Journal of Epidemiology and Community Health 62 (1): 69-74. PMID 18079336. doi:10.1136/jech.2006.052571.
- ↑ a b c d e Rubin, Philip; Jacqueline P. Williams (2003). Oncologia Clinica (8va edición). Elsevier, España. p. 823. ISBN 8481746274.
- ↑ «Gender in lung cancer and smoking research» (PDF). Organización Mundial de la Salud. 2004. Consultado el 26 de mayo de 2007.
- ↑ Liu, BQ; Peto R, Chen ZM et al. (November 1998). «Emerging tobacco hazards in China: 1. Retrospective proportional mortality study of one million deaths». British Medical Journal 317 (7170): 1411-1422. PMID 9822393. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Behera, D; Balamugesh T (2004). «Lung cancer in India». Indian Journal of Chest Diseases and Allied Sciences 46 (4): 269-281. PMID 15515828.
- ↑ a b c Surveillance and Risk Assessment Division, CCDP, Health Canada; citado por www.wrongdiagnosis.com. «Incidence Statistics for Types of Lung cancer». Diseases (en inglés). Consultado el 8 de mayo de 2008.
- ↑ a b Office on Women's Health in the U.S. Department of Health and Human Services (agosto de 2003). «Lung Cancer». National Women's Health Information Center (en inglés). Consultado el 8 de mayo de 2008.
- ↑ a b c d e f g h i Kumar, Vinay; Ramzi S. Cotran y Stanley L. Robbins (2008). Patología humana (7ma edición). Elsevier, España. p. 500. ISBN 8481746665.
- ↑ Samet, JM; Wiggins CL, Humble CG, Pathak DR (May 1988). «Cigarette smoking and lung cancer in New Mexico». American Review of Respiratory Disease 137 (5): 1110-1113. PMID 3264122.
- ↑ a b RACHTAN Jadwiga. Smoking, passive smoking and lung cancer cell types among women in Poland (en inglés). Lung cancer; 2002, vol. 35, no2, pp. 129-136 (26 ref.). ISSN 0169-5002. Último acceso 3 de mayo, 2008.
- ↑ a b c d e WANG, SOPHIA SSAMET, JONATHAN M. Tabaquismo y cáncer: la promesa de la epidemiología molecular. Salud pública Méx [online: en inglés]. 1997, vol. 39, no. 4 [accesado 2008-05-03], pp. 331-345. [1]. ISSN 0036-3634. doi: 10.1590/S0036-36341997000400011
- ↑ Tammemagi, CM; Neslund-Dudas C, Simoff M, Kvale P (January 2004). «Smoking and lung cancer survival: the role of comorbidity and treatment». Chest (American College of Chest Physicians) 125 (1): 27-37. PMID 14718417. doi:10.1378/chest.125.1.27. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ a b c d Sergio Sánchez Enríquez, Ramón Franco Topete, Luis Javier Flores Alvarado, Abraham Zepeda Moreno. Cáncer pulmonar (1a. de 2 partes) (en español). Rev Fac Med UNAM Vol.47 No.2 Marzo-Abril, 2004. Último acceso 3 de mayo, 2008.
- ↑ CDC (December 1986). «1986 Surgeon General's report: the health consequences of involuntary smoking». CDC. PMID 3097495. Consultado el 10 de agosto de 2007.
- ↑ Editorial El Mundo online (enero de 2004). «El riesgo de cáncer es el mismo con el tabaco 'bajo en alquitrán'». Consultado el 8 de mayo de 2008. «El riesgo de padecer cáncer de pulmón no es inferior entre aquellos fumadores que se deciden por los cigarrillos bajos en alquitrán.»
- ↑ MEHRA Reena; MOORE Brent A.; CROTHERS Kristina; TETRAULT Jeanette; FIELLIN David A. The association between marijuana smoking and lung cancer : A systematic review (en inglés). Archives of internal medicine. 2006, vol. 166, no13, pp. 1359-1367 [9 page(s) (article)]. ISSN 0003-9926. Último acceso 3 de mayo, 2008.
- ↑ Joseph L. Lyon, Kent Gardner and Richard E. Gress. Cancer Incidence among Mormons and Non-Mormons in Utah (United States) 1971-85 (en inglés). Cancer Causes & Control, Vol. 5, No. 2 (Mar., 1994), pp. 149-156. Último acceso 3 de mayo, 2008.
- ↑ Gary E. Fraser1,, W. Lowrence Beeson y Ronald L. Phillips2. Diet and Lung Cancer in California Seventh-day Adventists (en inglés). American Journal of Epidemiology Vol. 133, No. 7: 683-693. Último acceso 3 de mayo, 2008.
- ↑ Agencia para Sustancias Tóxicas y el Registro de Enfermedades. Hidrocarburos aromáticos policíclicos (HAPs) (en español). Septiembre, 1996. Último acceso 19 de mayo, 2008.
- ↑ Ryozo Eifuku y col. Heterogeneous Response Patterns of Alveolar Macrophages from Patients with Lung Cancer by Stimulation with Interferon-γ (en inglés). Japanese Journal of Clinical Oncology 30:295-300 (2000). Último acceso 19 de mayo, 2008.
- ↑ Fong, KM; Sekido Y, Gazdar AF, Minna JD (October 2003). «Lung cancer. 9: Molecular biology of lung cancer: clinical implications». Thorax (BMJ Publishing Group Ltd.) 58 (10): 892-900. PMID 14514947.
- ↑ Salgia, R; Skarin AT (March 1998). «Molecular abnormalities in lung cancer». Journal of Clinical Oncology 16 (3): 1207-1217. PMID 9508209.
- ↑ Aviel-Ronen, S; Blackhall FH, Shepherd FA, Tsao MS (July 2006). «K-ras mutations in non-small-cell lung carcinoma: a review». Clinical Lung Cancer (Cancer Information Group) 8 (1): 30-38. PMID 16870043.
- ↑ Devereux, TR; Taylor JA, Barrett JC (March 1996). «Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors». Chest (American College of Chest Physicians) 109 (Suppl. 3): 14S-19S. PMID 8598134. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Engels, EA; Wu X, Gu J et al. (July 2007). «Systematic evaluation of genetic variants in the inflammation pathway and risk of lung cancer». Cancer Research (American Association for Cancer Research) 67 (13): 6520-6527. PMID 17596594.
- ↑ Wenzlaff, AS; Cote ML, Bock CH et al. (December 2005). «CYP1A1 and CYP1B1 polymorphisms and risk of lung cancer among never smokers: a population-based study». Carcinogenesis (Oxford University Press) 26 (12): 2207-2212. PMID 16051642.
- ↑ Son, JW; Kang HK, Chae MH et al. (September 2006). «Polymorphisms in the caspase-8 gene and the risk of lung cancer». Cancer Genetics and Cytogenetics 169 (2): 121-127. PMID 16938569.
- ↑ Yin, J; Vogel U, Ma Y et al. (May 2007). «The DNA repair gene XRCC1 and genetic susceptibility of lung cancer in a northeastern Chinese population». Lung Cancer 56 (2): 153-160. PMID 17316890.
- ↑ Leroux, C; Girard N, Cottin V et al. (Mar-April 2007). «Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep». Veterinary Research 38 (2): 211-228. PMID 17257570.
- ↑ Palmarini, M; Fan H (November 2001). «Retrovirus-induced ovine pulmonary adenocarcinoma, an animal model for lung cancer». Journal of the National Cancer Institute (Oxford University Press) 93 (21): 1603-1614. PMID 11698564. doi:10.1093/jnci/93.21.1603. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Cheng, YW; Chiou HL, Sheu GT et al. (April 2001). «The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women». Cancer Research (American Association for Cancer Research) 61 (7): 2799-2803. PMID 11306446. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Giuliani, L; Jaxmar T, Casadio C et al. (September 2007). «Detection of oncogenic viruses (SV40, BKV, JCV, HCMV, HPV) and p53 codon 72 polymorphism in lung carcinoma». Lung Cancer 57 (3): 273-281. PMID 17400331.
- ↑ a b c Zosia Chustecka; Charles Vega (febrero de 2008). «Multivitamins Do Not Reduce Risk for Lung Cancer, and Vitamin E May Raise It» (en inglés). Medscape Medical News. Consultado el 13 de mayo de 2008. «The long-term use of supplemental multivitamins does not reduce the risk of developing lung cancer, and high doses of vitamin E may even raise the risk, particularly in smokers. These conclusions from a large, prospective study tie in with previous research, say the investigators.»
- ↑ Véase Carotene and Efficacy Trial (CARET) y el Alpha-Tocopherol, Beta-Carotene (ATBC) Lung Cancer Prevention Study
- ↑ a b c d Laurie Barclay; Hien T. Nghiem (septiembre de 2007). «New Guidelines Issued on Lung Cancer Diagnosis and Management» (en inglés). Medscape Medical News. Consultado el 13 de mayo de 2008.
- ↑ CLAVERO R, JOSÉ M, VILLANUEVA G, PABLO, SOLOVERA R, MARÍA E et al. Tumor de Pancoast con lesión hipofísiaria sincrónica. Rev. chil. enferm. respir. [online]. sep. 2007, vol.23, no.3 [citado 02 Mayo 2008], p.197-202. Disponible en la World Wide Web: [2]. ISSN 0717-7348.
- ↑ a b c d e Irfan Maghfoor y col. Marzo, 2006. Lung Cancer, Oat Cell (Small Cell) (artículo completo disponible en inglés). eMedicine.com (WebMD): Oncología. Último acceso 3 de septiembre, 2008.
- ↑ TULESKI, MARCELO JOSÉ, ESCUISSATO, DANTE LUIZ and BARROS, JOÃO ADRIANO DE. Imagem por ressonância magnética em paciente jovem com hemoptise e radiografia de tórax normal. J. Pneumologia [online]. 2000, vol. 26, no. 2 [cited 2008-05-16], pp. 81-82. Available from: [3]. ISSN 0102-3586. doi: 10.1590/S0102-35862000000200007
- ↑ BERNAL BERNAL, R., LEON JIMENEZ, A., JAEN OLASOLO, J. et al. Recidiva local tras la cirugía del cáncer de pulmón no microcrítico: Factores pronósticos. An. Med. Interna (Madrid). [online]. 2008, vol. 25, no. 2 [citado 2008-05-16], pp. 55-60. Disponible en: [4]. ISSN 0212-7199.
- ↑ a b c d e f Instituto Nacional del Cáncer (febrero de 2008). «Cáncer de pulmón de células no pequeñas: Tratamiento (PDQ®)». Consultado el 8 de mayo de 2008.
- ↑ El-Sherif, A; Gooding WE, Santos R et al. (August 2006). «Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer: a 13-year analysis». Annals of Thoracic Surgery 82 (2): 408-415. PMID 16863738.
- ↑ Strand, TE; Rostad H, Damhuis RA, Norstein J (June 2007). «Risk factors for 30-day mortality after resection of lung cancer and prediction of their magnitude». Thorax (BMJ Publishing Group Ltd.). PMID 17573442.
- ↑ A. Wein y col. Impacto de la cirugía sobre la supervivencia en pacientes paliativos con cáncercolorrectal metastásico después del tratamiento de primera línea con infusión semanal de 24 horas de 5-fluorouracilo y ácido folínico a dosis altas (en español). Annals of Oncology 11: 223-230; 2002. Último acceso 13 de mayo, 2008.
- ↑ a b c Grupo de Medicina Basada en la Evidencia - Hospital Universitario 12 de Octubre. Carcinoma broncogénico: FASE B – Clínica Respiratoria (en español). Último acceso 13 de mayo, 2008.
- ↑ HERRERA V., José M., ROSSI F., Ricardo, HARRIS D., Paul et al. Progresos en el tratamiento y seguimiento de hepatoblastoma: Análisis de una serie de 9 niños. Rev. chil. pediatr. [online]. ene. 2002, vol.73, no.1 [citado 13 Mayo 2008], p.43-50. Disponible en la World Wide Web: [5]. ISSN 0370-4106.
- ↑ SAINZ MENENDEZ, Benito. Tumores benignos y malignos del pulmón: Clasificación. Diagnóstico. Tratamiento. Rev Cubana Cir. [online]. jul.-dic. 2006, vol.45, no.3-4 [citado 13 Mayo 2008], p.0-0. Disponible en la World Wide Web: [6]. ISSN 0034-7493.
- ↑ Fernando, HC; Santos RS, Benfield JR et al. (February 2005). «Lobar and sublobar resection with and without brachytherapy for small stage IA non-small cell lung cancer». Journal of Thoracic and Cardiovascular Surgery 129 (2): 261-267. PMID 15678034.
- ↑ Murray, N; Turrisi AT (March 2006). «A review of first-line treatment for small-cell lung cancer». Journal of Thoracic Oncology 1 (3): 270-278. PMID 17409868.
- ↑ Clegg, A; Scott DA, Hewitson P et al. (January 2002). «Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review». Thorax (BMJ Publishing Group Ltd) 57 (1): 20-28. PMID 11809985.
- ↑ Azim, HA; Ganti AK (March 2007). «Treatment options for relapsed small-cell lung cancer». Anticancer drugs 18 (3): 255-261. PMID 17264756.
- ↑ MacCallum, C; Gillenwater HH (July 2006). «Second-line treatment of small-cell lung cancer». Current Oncology Reports 8 (4): 258-264. PMID 17254525.
- ↑ Tramer MR, Carroll D, Campbell FA, Reynolds DJ, Moore RA, McQuay HJ. Cannabinoids for control of chemotherapy induced nausea and vomiting: quantitative systematic review. BMJ 2001;323:16-21. PMID 11440936.
- ↑ a b c d e f g h i j [Sociedad Americana del Cáncer (American Cancer Society, Inc.)] Comprueba el valor del
|enlaceautor=(ayuda) (noviembre de 2004). «Tratamiento:¿Cómo se trata el cáncer del pulmón?». Consultado el 8 de mayo de 2008. - ↑ a b c d Wagner, H (January 1998). «Radiation therapy in the management of limited small cell lung cancer: when, where, and how much?». Chest (American College of Chest Physicians) 113 (Suppl. 1): 92S-100S. PMID 9438697. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda) Texto completo (en inglés). - ↑ Parent, ME; Rousseau MC, Boffetta P et al. (January 2007). «Exposure to diesel and gasoline engine emissions and the risk of lung cancer». American Journal of Epidemiology 165 (1): 53-62. PMID 17062632.
Enlaces externos
- Información sobre Cáncer de Pulmón para médicos Medscape en Español
- Cáncer de pulmón (Noticias e información acerca del cáncer de pulmón)
- Situación epidemiológica y pronóstica del cáncer de pulmón en España. En Archh Bronconeumol 2006;42(11):594-9
- Carcinoma broncogéncio. Revisión del Grupo MBE del Hospital 12 de octubre(marzo-2007)
- El cáncer de pulmón, ficha informativa del National Cancer Institute
- Web de ayuda a enfermos de cáncer y familiares.
- En MedlinePlus hay más información sobre Cáncer de pulmón
- Tutoriales Interactivos de Salud Medline Plus: Cáncer de pulmón Utiliza gráficas animadas y se puede escuchar el tutorial
