Carcinoma renal
| Carcinoma de células renales | ||
|---|---|---|
 | ||
| Especialidad | oncología | |
El carcinoma de células renales es la forma más frecuente de cáncer de riñón, especialmente en adultos, originado de los túbulos renales.
Los síntomas de la enfermedad tardan mucho en aparecer y, como resultado, las personas con carcinoma de células renales a menudo tienen una enfermedad avanzada cuando se la descubre.[1] Los síntomas iniciales de carcinoma de células renales a menudo incluyen sangre en la orina.
El tratamiento inicial es quirúrgico pues tiene la peculiaridad de ser resistente a la radioterapia y la quimioterapia, aunque algunos casos han respondido favorablemente a la inmunoterapia.
El tratamiento inicial suele ser la extracción parcial o completa del o los riñones afectados.[2] Cuando el cáncer no ha hecho metástasis, es decir cuando no se ha diseminado a otros órganos o cuando se encuentra ubicado más profundamente en los tejidos del riñón, la tasa de supervivencia a cinco años es del 65 al 90%,[3] pero esto disminuye considerablemente cuando el cáncer se ha diseminado.
El advenimiento de la inmunoterapia y terapias antitumorales dirigidas, tales como sunitinib, temsirolimus, bevacizumab y sorafenib,[4] ha mejorado las pautas de tratamiento para esta enfermedad.[5]
Epidemiología
[editar]La incidencia del carcinoma de células claras varía según factores geográficos, demográficos y, en menor medida, hereditarios. Existen algunos factores de riesgo conocidos para su desarrollo, sin embargo, la importancia de otros potenciales sigue siendo controvertida. Los más comunes incluyen tabaquismo, factores genéticos y hemodiálisis. La incidencia de este cáncer ha aumentado en todo el mundo a una tasa de aproximadamente 2 a 3% por década[6] hasta los últimos años, en los que el número de casos nuevos se ha estabilizado.[7] Esta patología es más común en personas entre 50 y 70 años de edad[8] y tiende a ser más frecuente en hombres que en mujeres (aproximadamente 1,6:1).[8] Cerca de un tercio de los pacientes presentan metástasis al momento del diagnóstico. Los países desarrollados tienen una mayor incidencia que los que se encuentran en vías de desarrollo, con las tasas más altas registradas en América del Norte, Europa y Australia/Nueva Zelanda.[9] En Latinoamérica el país con más alta incidencia de cáncer de células renales es Uruguay.[10]
Cuadro clínico
[editar]La tríada clásica del cáncer de riñón es sangre en la orina, dolor en un costado y la aparición de una masa abdominal. A esta tríada se le conoce como la tríada demasiado tarde, pues para cuando el paciente presenta los tres síntomas la enfermedad ha avanzado más allá de un punto curativo. En la actualidad, la mayoría de los tumores renales son asintomáticos y se detectan accidentalmente durante un examen de imagenología, por lo general en busca de causas no relacionadas.
Los síntomas iniciales de carcinoma de células renales a menudo incluyen sangre en la orina (que ocurre en el 40% de las personas afectadas en el momento en que buscan atención médica por primera vez), dolor abdominal (40%), una masa en el abdomen (25%), pérdida de peso (33%), fiebre (20%), presión arterial alta (20%), sudores nocturnos y, en general, malestar.[11] Cuando el carcinoma de células renales hace metástasis, se disemina con mayor frecuencia a los ganglios linfáticos, los pulmones, el hígado, las glándulas suprarrenales, el cerebro o los huesos.[12] La inmunoterapia y la terapia dirigida han mejorado el pronóstico para el cáncer de células renales metastásico.[13][5]
Otros signos pueden incluir:
- Color anormal de la orina (marrón, rojizo, cobre, etc) debido a la aparición de hematíes en la orina.
- Pérdida de peso y aspecto desnutrido.
- El principal síntoma puede ser debido a una enfermedad metastásica, tal como la fractura patológica de un hueso por diseminación ósea.
- Varicocele o agrandamiento de un testículo por bloqueo de la vena gonadal, por lo general del lado izquierdo debido a la compresión de la vena renal por el tumor (la vena gonadal drena directamente a la vena cava inferior).
- Alteraciones de la visión.
- Palidez por hipervolemia.
- Hirsutismo (crecimiento excesivo de vello en las mujeres).
- Estreñimiento
- Hipertensión arterial
- Valores elevados de calcio (hipercalcemia)
Etiología
[editar]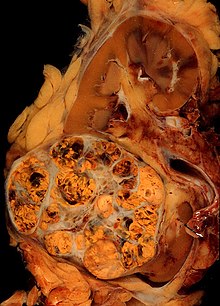
Se desconoce exactamente cuál es la razón de la aparición de células cancerosas en el riñón. Se sabe que los antecedentes personales de tabaquismo aumenta el riesgo de un carcinoma de células renales. Ciertas personas pueden haber heredado el riesgo de un cáncer renal por lo que es importante la historia familiar del individuo.
Se ha comenzado a pensar que la inhalación de diversos químicos puede ser causal y se ha notado que hay un continuo aumento en el diagnóstico en mujeres. Se ha visto también un porcentaje desproporcionado de personas obesas con cáncer de riñón, por lo que se espera que ese trastorno sea un factor de importancia. Aquellos con el Síndrome de von Hippel-Lindau, una enfermedad hereditaria que también afecta los capilares del cerebro, con frecuencia son diagnosticados con cáncer renal. En riesgo están también quienes, por otras enfermedades del riñón, requieren de tratamiento por hemodiálisis.
Anatomía patológica
[editar]La apariencia macroscópica muestra un tumor multilobulado de color amarillento situado en la corteza renal, el cual con frecuencia contiene zonas de necrosis, hemorragia y fibrosis. Bajo el microscopio, se ven en el tumor células que forman cordones, papilas, túbulos o nidos y que tienden a ser células atípicas, poligonales y de gran tamaño. Debido a que estas células acumulan glucógeno y lípidos, su citoplasma tiene una apariencia clara con el núcleo celular central y una membrana plasmática evidente. Algunas células pueden ser de menor tamaño con un citoplasma rojizo o eosinofílico, muy similares a las células tubulares normales. El estroma se encuentra reducido y bien vascularizado. El tumor comprime el parénquima que le rodea, produciendo una pseudo-cápsula.[14] La producción y secreción de sustancias vasoactivas, como la renina, pueden causar hipertensión arterial y la liberación de eritropoyetina puede causar una producción aumentada de glóbulos rojos o eritrocitosis.
Histología
[editar]El carcinoma de células renales tiene 5 tipos histológicos:
- Células claras, representan un 75% de los casos, tienden a tener origen en el túbulo proximal y se presentan con tumores de células inusualmente claras por el citoplasma rico en glucógeno y lípidos. Es generalmente el tipo de cáncer renal con modificación genética, por lo general una deleción en el cromosoma 3.
- Tumores cromofílicos o papilares, representan un 15% de los carcinomas de células renales, tienden a ser bilaterales o multifocales y pueden tener una trisomía 7 y/o 17. Crecen en forma papilar y por lo general provienen de células del túbulo proximal de la nefrona.
- Células poligonales largas, a pesar de tener un citoplasma pálido, tiende a ser reticular, tienen un curso indolente y forman tumores sólidos o sarcomatoides. Tienden a ser células hipodiploides y provienen de células del conducto colector cortical. Representan aproximadamente 3% de los carcinomas de células renales.
- Oncocitoma renal, consiste predominantemente de células eosinofílicas que raramente causan metástasis y no exhiben citogenética como las anteriores. Constituyen un 3% de los casos y provienen de células del conducto colector cortical.
- Carcinoma de células colectoras, es una variante poco frecuente, usualmente menos del 2% caracterizado por un curso clínico agresivo de células que provienen del túbulo colector medular..
Estadificación
[editar]La estadificación del carcinoma de riñón es muy similar a la estadificación de otros tumores malignos, con aplicación al riñón diseñada por y denominada Flocks y Kadesky:
- Estadio I: cuando el tumor se encuentra dentro de la cápsula renal.[15]
- Estadio II: el tumor ha alcanzado invadir el tejido adiposo que rodea al riñón mas no traspasa la fascia o cápsula de Gerota que rodea al riñón.[16]
- Estadio III: el tumor ha invadido la vena renal o la vena cava inferior, ha habido infiltración de ganglios linfáticos regionales o ambos casos.[17]
- Estadio IV: el tumor invade vísceras adyacentes, excluyendo la glándula adrenal del mismo lado o bien han aparecido metástasis distantes.[18]
Otro sistema usado con frecuencia en el diagnóstico del carcinoma de células renales es el sistema TNM, reportado por patólogos, radiólogos, etc:
- Tumor primario (T):
- TX – Tumor primario no puede ser estudiado,
- T0 – No se encuentran evidencias de un tumor primario
- T1 – Tumor de 7 cm o más pequeño en sus dimensiones más grandes y limitado al riñón
- T2 – Tumor mayor a 7 cm en su dimensión mayor, limitado al riñón
- T3 – Tumor se extiende a las principales venas renales o invade las suprarrenales o tejidos peri-renales, incluyendo tejido graso, sin pasarse de la fascia de Gerota
- T3a – Tumor invado la glándula suprarrenal o tejidos peri-renales sin pasarse de la fascia de Gerota
- T3b – Tumor se extiende hacia las venas renales, vena cava por debajo del diafragma
- T3c – Tumor se extiende por las venas renales o la vena cava por encima del diafragma
- T4 – Tumor invade más allá de la fascia o cápsula de Gerota que rodea al riñón
- Nódulos linfáticos regionales (N)
- NX – Los ganglios linfáticos no son accesibles para estudio
- N0 – No se aprecia metástasis de ganglios linfáticos regionales
- N1 - Metástasis en un ganglio linfático
- N2 - Metástasis en más de 1 nódulo linfático
- Metástasis distantes (M)
- MX – Metástasis distante no puede ser estudiada
- M0 – No se aprecian metástasis distantes
- M1 – Metástasis distantes evidentes
- Estadios
- Estadio I - T1, N0, M0
- Estadio II - T2, N0, M0
- Estadio III - T1-2, N1, M0 o T3a-c, N0-1, M0
- Estadio IV - T4; o cualquier T, N2, M0; o cualquier T, cualquier N, M1
Tratamiento
[editar]Las opciones de tratamiento para el cáncer de células renales son la cirugía, radioterapia, quimioterapia, terapia hormonal, inmunoterapia o una combinación de estas. Más del 50% de los pacientes con cáncer de células renales se curan en los estadios iniciales de la enfermedad, pero el pronóstico para el estadio IV es considerablemente malo. La probabilidad de cura depende directamente en el estadio, es decir, el grado de diseminación del tumor, de modo que el abordaje es curativo en las etapas tempranas.
Cáncer metastásico
[editar]Para los pacientes con cáncer metastásico, el sunitinib probablemente da como resultado una mayor progresión del cáncer que pembrolizumab, axitinib y avelumab.[19] En comparación con el pembrolizumab y el axitinib, probablemente provoque más muertes, pero puede reducir levemente los efectos no deseados graves.[19] En comparación con las combinaciones de inmunoterapia (nivolumab e ipilimumab), el sunitinib puede producir una mayor progresión y efectos graves.[19] Puede haber poca o ninguna diferencia en la progresión, la supervivencia y los efectos graves entre pazopanib y sunitib.[19]
Metástasis y cambios genómicos
[editar]Se ha observado en estudios de comparación genómica pan-cáncer entre tumores primarios y metastásicos que los tumores metastásicos de carcinoma renal de células claras muestran una menor heterogeneidad intratumoral, lo que sugiere una selección de subclones más agresivos durante la metástasis.[20] Al igual que en otros tipos de cáncer, se han observado cambios en el paisaje genómico del cáncer de riñón durante la progresión de la enfermedad, lo que podría tener implicaciones importantes en su manejo clínico. Se observaron cambios considerables en el perfil de aneuploidía cromosómica y en la carga mutacional, con alteraciones genéticas más pronunciadas en comparación con el cáncer primario, destacando la aparición de mutaciones en el gen conductor PTPRD exclusivamente en tumores metastásicos y no en los equivalentes de tumores primarios.
Referencias
[editar]- ↑ Fausto, V; Abbas, A; Fausto, N (2004). Elsevier/Saunders, ed. Robbins and Cotran Pathologic Basis of disease. Philadelphia. ISBN 978-0721601878.
- ↑ Rini, Brian I; Rathmell, W Kimryn; Godley, Paul (2008-5). «Renal cell carcinoma:». Current Opinion in Oncology (en inglés) 20 (3): 300-306. ISSN 1040-8746. doi:10.1097/CCO.0b013e3282f9782b. Consultado el 22 de septiembre de 2019.
- ↑ «Kidney cancer». nhs.uk (en inglés). 23 de octubre de 2017. Consultado el 22 de septiembre de 2019.
- ↑ La FDA aprueba el sunitinib para el cáncer renal y gastrointestinal Archivado el 10 de junio de 2008 en Wayback Machine. (en español). e-Medicum.com - Último acceso 28 de mayo de 2008.
- ↑ a b Syn, Nicholas L; Teng, Michele W L; Mok, Tony S K; Soo, Ross A (2017-12). «De-novo and acquired resistance to immune checkpoint targeting». The Lancet Oncology (en inglés) 18 (12): e731-e741. doi:10.1016/S1470-2045(17)30607-1. Consultado el 22 de septiembre de 2019.
- ↑ Gupta, Kiran; Miller, Jeffrey D.; Li, Jim Z.; Russell, Mason W.; Charbonneau, Claudie (2008-05). «Epidemiologic and socioeconomic burden of metastatic renal cell carcinoma (mRCC): A literature review». Cancer Treatment Reviews 34 (3): 193-205. ISSN 0305-7372. doi:10.1016/j.ctrv.2007.12.001. Consultado el 1 de octubre de 2019.
- ↑ Ljungberg, Börje; Campbell, Steven C.; Cho, Han Yong; Jacqmin, Didier; Lee, Jung Eun; Weikert, Steffen; Kiemeney, Lambertus A. (2011-10). «The Epidemiology of Renal Cell Carcinoma». European Urology 60 (4): 615-621. ISSN 0302-2838. doi:10.1016/j.eururo.2011.06.049. Consultado el 2 de octubre de 2019.
- ↑ a b Cohen, Herbert T.; McGovern, Francis J. (8 de diciembre de 2005). «Renal-Cell Carcinoma». New England Journal of Medicine 353 (23): 2477-2490. ISSN 0028-4793. doi:10.1056/nejmra043172. Consultado el 2 de octubre de 2019.
- ↑ Birkhäuser, Frédéric D.; Kroeger, Nils; Pantuck, Allan J. (7 de agosto de 2012). Renal Cell Carcinoma. Humana Press. pp. 3-22. ISBN 9781627030618. Consultado el 2 de octubre de 2019.
- ↑ Eble JN, Sauter G, Epstein JI, Sesterhenn IA (Eds): World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of the Urinary System and Male Genital Organs. IARC Press, Lyon, 2004. Citado por KidneyPathology.com.
- ↑ Renal Cell Carcinoma: Practice Essentials, Background, Pathophysiology. 30 de mayo de 2019. Consultado el 22 de septiembre de 2019.
- ↑ «Renal Cell Carcinoma - Genitourinary Disorders». Merck Manuals Professional Edition (en inglés estadounidense). Consultado el 22 de septiembre de 2019.
- ↑ Singer, Eric A.; Gupta, Gopal N.; Marchalik, Daniel; Srinivasan, Ramaprasad (2013-5). «Evolving therapeutic targets in renal cell carcinoma:». Current Opinion in Oncology (en inglés) 25 (3): 273-280. ISSN 1040-8746. doi:10.1097/CCO.0b013e32835fc857. Consultado el 22 de septiembre de 2019.
- ↑ «pathologyatlas.ro». Archivado desde el original el 27 de septiembre de 2007. Consultado el 29 de diciembre de 2007.
- ↑ Instituto Nacional del Cáncer. Cáncer de riñón en estadio I Archivado el 4 de mayo de 2008 en Wayback Machine. (en español). Diccionario de cáncer.
- ↑ Instituto Nacional del cnacer cancerigeno canceroso maravilloso y jocoso colonoso Cáncer. cáncer de riñón en estadio II Archivado el 4 de mayo de 2008 en Wayback Machine. (en español). Diccionario de cáncer.
- ↑ Instituto Nacional del Cáncer. cáncer de riñón en estadio II Archivado el 17 de septiembre de 2008 en Wayback Machine. (en español). Diccionario de cáncer.
- ↑ Instituto Nacional del Cáncer. cáncer de riñón en estadio II Archivado el 17 de septiembre de 2008 en Wayback Machine. (en español). Diccionario de cáncer.
- ↑ a b c d Hofmann, Fabian; Hwang, Eu Chang; Lam, Thomas BL; Bex, Axel; Yuan, Yuhong; Marconi, Lorenzo SO; Ljungberg, Börje (14 de octubre de 2020). «Targeted therapy for metastatic renal cell carcinoma». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). doi:10.1002/14651858.CD012796.pub2. Consultado el 15 de marzo de 2021.
- ↑ Martínez-Jiménez, Francisco; Movasati, Ali; Brunner, Sascha Remy; Nguyen, Luan; Priestley, Peter; Cuppen, Edwin; Van Hoeck, Arne (2023-06). «Pan-cancer whole-genome comparison of primary and metastatic solid tumours». Nature (en inglés) 618 (7964): 333-341. ISSN 1476-4687. PMC 10247378. PMID 37165194. doi:10.1038/s41586-023-06054-z. Consultado el 5 de enero de 2024.
