Ácido lipoico
| Ácido lipoico | ||
|---|---|---|
 | ||
| General | ||
| Fórmula estructural |
| |
| Fórmula molecular |
C 8H 14O 2S 2 | |
| Identificadores | ||
| Número CAS | 1200-22-2[1] | |
| ChEBI | 16494 | |
| ChEMBL | CHEMBL33864 | |
| ChemSpider | 5886 | |
| PubChem | 6112 | |
| UNII | 73Y7P0K73Y | |
| KEGG | D00086 C00725, D00086 | |
| Propiedades físicas | ||
| Apariencia | Cristales amarillos en forma de aguja | |
| Masa molar | 20 633 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
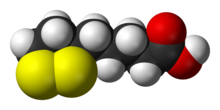
El ácido lipoico, también conocido como ácido α-lipoico,[2] ácido alfa lipoico (ALA), ácido tióctico,[3] 6,8-ácido tióctico, 6,8- ácido ditioctano y 1,2-ácido ditiol-3-valérico, es un derivado del ácido graso octanoico. Se halla unido covalentemente a un resto específico de lisina de la enzima con quien colabora; en tal caso se acostumbra a llamar lipoamida. El LA aparece físicamente como un sólido de color amarillo y en su estructura contiene un terminal carboxílico y un anillo ditional.
Propiedades físicas y químicas
[editar]La forma oxidada del ácido lipoico (LA) es un disulfuro cíclico y la forma reducida posee dos grupos sulfhidrilo (–SH) (ácido dihidrolipoico).
El átomo de carbono en C6 es quiral y la molécula puede existir en diferentes formas: dos enantiómeros [ácido lipoico (R)-(+) (RLA) y ácido lipoico (S)-(-) (SLA)] y como una mezcla racémica [ácido lipoico (R/S) (R/S-LA)], siendo esta última su forma de administración más usual hoy en día.
El LA es una molécula pequeña que contiene 2 grupos tiol oxidados o reducidos. Su forma oxidada es normalmente definida como ácido alfa-lipoico o solo ácido lipoico, y la forma reducida de LA es conocida como ácido dihidrolipoico (DHLA). La DHLA es la forma predominante que interacciona con las especies reactivas de oxígeno (ROS), pero la forma oxidada también puede inactivar los ROS.[4]
El LA es relativamente estable como sólido, pero se polimeriza cuando es calentado por encima de su punto de fusión (47,5°) o bajo la influencia de luz cuando se encuentra disuelto en una solución neutral.
Tanto LA cómo DHLA son moléculas que poseen tanto propiedades hidrofílicas como hidrofóbicas.
Función biológica
[editar]El lipoato es la base conjugada del ácido lipoico, y la forma más frecuente de LA en condiciones fisiológicas. La mayor parte del RLA producido endógenamente no es "libre", ya que el ácido octanoico, precursor del RLA, se une a los complejos enzimáticos antes de la inserción enzimática de los átomos de azufre. Como cofactor, el RLA se une covalentemente mediante un enlace amida a un residuo de lisina terminal de los dominios lipoil de la enzima. Una de las funciones más estudiadas del RLA es la de cofactor del complejo piruvato deshidrogenasa (PDC o PDHC), aunque también es cofactor en otros sistemas enzimáticos (se describe a continuación).
Solo el -enantiómero (R) - (+) (RLA) existe en la naturaleza y es esencial para el metabolismo aeróbico porque el RLA es un cofactor esencial de muchos complejos enzimáticos.[5]
Biosíntesis y unión
[editar]El precursor del ácido lipoico, el ácido octanoico, se forma a través de la biosíntesis de ácidos grasos en forma de la proteína portadora octanoil-acilo. En eucariotas, una segunda vía de biosíntesis de ácidos grasos en la mitocondria se utiliza para este propósito.[6][7] El octanoato se transfiere como un tioéster de la proteína portadora de acilo de biosíntesis de ácidos grasos en una amida de la proteína de dominio lipoil por una enzima llamada octanoiltransferasa. El lipoil sintasa[8] sustituye dos hidrógenos de octanoato por grupos de azufre a través de un mecanismo de radicales SAM. Como resultado, el ácido lipoico se sintetiza unido a proteínas y no se produce el ácido lipoico libre. El ácido lipoico se puede retirar cada vez que las proteínas se degradan y por acción de la enzima lipoamidasa.[9] El lipoato libre puede ser utilizado por algunos organismos como enzima denominada proteína ligasa lipoática que lo une de forma covalente a su respectiva proteína. La actividad de la ligasa de esta enzima requiere ATP.[10] El ser humano y otros animales pueden sintetizar LA de novo a partir de ácidos grasos y cisteína, pero en cantidades muy pequeñas, con lo cual debe de existir un aporte exógeno de LA.
Actividad enzimática
[editar]El ácido lipoico está implicado generalmente en descarboxilaciones oxidativas de cetoácidos, y es un factor de crecimiento para algunos organismos. El ácido lipoico existe como dos enantiómeros, el enantiómero R y el enantiómero S. Normalmente solo el enantiómero R de un aminoácido es biológicamente activo. Algunos estudios recientes han sugerido que el enantiómero S tiene un efecto inhibidor sobre el enantiómero R, reduciendo sustancialmente su actividad biológica y aumentando el estrés oxidativo en lugar de reducirlo. Además, se ha descubierto que el enantiómero S reduce la expresión de GLUT-4 en las células, responsables de la captación de glucosa.[11]

El ácido lipoico es cofactor de al menos cinco sistemas enzimáticos. Dos de ellos se encuentran en el ciclo del ácido cítrico (ciclo de Krebs) a través del cual muchos organismos transforman los nutrientes en energía. En este ciclo, actúa a nivel de E2 y E3, en la alfa-cetoglutarato deshidrogenasa, en la 2-oxoadipato deshidrogenasa, en la cetoácido de cadena ramificada deshidrogenasa y en el sistema de escisión de la glicina.[4] Estas enzimas tienen ácido lipoico unido a ellas en forma covalente. El grupo lipoil transfiere grupos acilo en los complejos 2-oxoácido deshidrogenasa, y grupos metilamina en el complejo de escisión de glicina o glicina deshidrogenasa.
Las reacciones de transferencia del 2-oxoácido deshidrogenasa se producen por un mecanismo similar en:
- el complejo piruvato deshidrogenasa
- la α-cetoglutarato deshidrogenasa o complejo 2-oxoglutarato deshidrogenasa
- el complejo oxoácido deshidrogenasa de cadena ramificada
- el complejo de acetoína deshidrogenasa.
El más estudiado de estos es el complejo de la piruvato deshidrogenasa. Estos complejos tienen tres subunidades centrales: E1-3, que son la descarboxilasa, lipoil-transferasa y dihidrolipoamida deshidrogenasa, respectivamente. Estos complejos tienen un núcleo E2 central y las otras subunidades rodean este núcleo para formar el complejo. En la brecha entre estas dos subunidades, el dominio lipoilo transporta intermediarios entre los centros activos.[12] El dominio lipoil está unido por sí mismo mediante un enlace flexible al núcleo E2 y el número de dominios lipoil varía de uno a tres para cada organismo. El número de dominios se ha variado de forma experimental y, añadiendo nueve o más dominios parece tener poco efecto sobre el crecimiento, en cambio, añadiendo más de tres, la actividad del complejo se ve disminuida.[13]
El ácido lipoico sirve como cofactor para el complejo acetoína deshidrogenasa catalizando la conversión de acetoína (3-hidroxi-2-butanona) a acetaldehído y acetil coenzima A en algunas bacterias, lo que permite que la acetoína pueda ser utilizada como única fuente de carbono.
El sistema de escisión de glicina es diferente a los otros complejos, y tiene una nomenclatura diferente también. Los componentes individuales están sueltos. En este sistema, la proteína H se presenta como un dominio lipoil libre con hélices adicionales, la proteína L es una dihidrolipoamida deshidrogenasa, la proteína P es la descarboxilasa, y la proteína T transfiere la metilamina de lipoato al tetrahidrofolato (THF) produciendo metilén-THF y amoníaco. El metilén-THF se utiliza entonces por la serina hidroximetiltransferasa para sintetizar serina a partir de glicina. Este sistema es parte de la fotorrespiración de las plantas.[14]
Fuentes biológicas y degradación
[editar]El ácido lipoico está presente en casi todos los alimentos, pero se ha verificado en mayor cantidad en el riñón, corazón e hígado de bovinos. También se encuentra en mayor cantidad en las espinacas, brócoli y extracto de levadura.[15] El ácido lipoico en la naturaleza está siempre unido covalentemente y la cantidad de ácido lipóico que se puede adquirir de la dieta es muy escasa. En caso de existir un déficit de éste se recurre a su síntesis química en forma R/S-AL y no en forma R-AL cómo se encuentra a nivel celular.
No se han detectado niveles de referencia (antes de la suplementación) de RLA y R-DHLA en el plasma humano.[16] Se ha detectado RLA en 12,3 a 43,1 ng / ml después de la hidrólisis ácida, que libera ácido lipoico desde una proteína. La hidrólisis enzimática de ácido lipoico ligada a la proteína libera 1.4 a 11.6 ng / mL y <1 a 38,2 ng / ml utilizando subtilisina y Alcalasa, respectivamente.[17][18][19]
Las enzimas digestivas proteolíticas escinden el residuo R-lipoyllysine de los complejos de enzimas mitocondriales derivados de la comida, pero no son capaces de romper el enlace amida de lisina ácido-L-lipoico.[20] Tanto la lipoamida sintética como la (R) -lipoyl-L-lisina se escinden rápidamente por los serum lipoamidasas, que liberan ácido (R) lipoico libre ya sea L-lisina o amoníaco.[21][22][23][24][25]
Se sabe poco sobre la degradación y la utilización de sulfuros alifáticos tales como ácido lipoico, a excepción de la cisteína. Ciertas bacterias pueden utilizar el ácido lipoico como fuente de carbono, azufre, y energía. Un abundante intermediario en la degradación del ácido lipoico es el ácido bisnorlipoico.[26][27] A pesar de que las enzimas de degradación de ácidos grasos parecen participar en el proceso, no se conocen los productos genéticos responsables de la utilización de ácido lipoico como fuente de azufre.
La degradación de este ácido ocurre principalmente a nivel gástrico, por acción de los enzimas subtilisina y alcalasa. En primer lugar ocurre una hidrólisis ácida (subtilisina) en que el ácido lipoico está unido a una proteína, y enseguida, debido a la acción de la alcalasa, ocurre una hidrólisis enzimática
El ácido lipoico se metaboliza en una variedad de formas cuando se administra como un suplemento dietético en los mamíferos.[28] El ácido lipoico se degrada parcialmente por una variedad de transformaciones, que puede ocurrir en varias combinaciones. Se observó la degradación a ácido tetranorlipoico, la oxidación de uno o ambos de los átomos de azufre a sulfóxido y S-metilación del sulfuro. Se detectó especialmente en ratones la conjugación del ácido lipoico no modificado a glicina.[28] La degradación de ácido lipoico es similar en los seres humanos, aunque no está claro si los átomos de azufre se oxidan de manera significativa.[29] Aparentemente los mamíferos no son capaces de utilizar el ácido lipoico como una fuente de azufre.
Síntesis química del ácido lipoico
[editar]La SLA no existía antes de la síntesis química en 1952.[30][31] El SLA se produjo en cantidades iguales con RLA durante los procesos de fabricación aquirales. La forma racémica fue más ampliamente utilizado clínicamente en Europa y Japón en los años 1950 a 1960 a pesar de que se sabía de que las diversas formas de LA no son bioequivalentes.[32] Los primeros procedimientos sintéticos de RLA y SLA aparecieron a mediados de la década de 1950.[33][34][35][36] Los avances en la química quiral llevaron tecnologías más eficientes para la fabricación de los enantiómeros individuales tanto por resolución clásica como la síntesis asimétrica y la demanda de RLA también creció en este momento. En el siglo 21, R / S-LA, RLA y SLA con alta pureza óptica y/o química estaban disponibles en cantidades industriales. En el momento actual, la mayor parte de la oferta mundial de R / S-LA y RLA es fabricado en China y en cantidades más pequeñas en Italia, Alemania y Japón. El RLA es producido por la modificación de un procedimiento descrito por primera vez por Georg Lang en un Ph.D. tesis y posteriormente patentado por Degussa.[37] Aunque el RLA se ve favorecida nutricionalmente debido a su papel "similar a las vitaminas" en el metabolismo, tanto RLA y R / S-LA están ampliamente disponibles como suplementos dietéticos. Ambas reacciones estereoespecíficos y no estereoespecíficos se sabe que ocurren in vivo y contribuyen a los mecanismos de acción, pero la evidencia hasta la fecha indica que el RLA puede ser el eutómero (la forma nutricionalmente y terapéuticamente preferido).[38][39]
A continuación se describen los pasos que sigue la síntesis de LA:
1. El primer paso en la síntesis de ácidos grasos es la formación de malonil-CoA catalizado por HFA1 o por la malonil-CoA sintetasa (ACSF3), dependiendo del origen del ácido malónico.
2. Transferencia de malonil-CoA hacia ell grupo prostético ACP, catalizado por malonil-CoA: aciltransferasa, formando Malonil-ACP.
3. El Malonil-ACP es metabolizado en 3-Cetoacil-ACP, por la 3-oxoacil-(proteína transportadora de acilo) sintetasa.
4. El 3-cetoacil-ACP es reducido a 3-hidroxiacil-ACP, por la 3-oxoacil-(proteína transportadora de acilo) transferasa.
5. El 3-hidroxiacil-ACP es metabolizado a 2-trans-enol-ACP, por la 3-hidroxiacil-tioéster-deshidratasa.
6. El último paso de este ciclo lo realiza la trans-2-enol-CoA reductasa que cataliza la reducción de 2-transenol-ACP a acil-ACP.
7. El acil-ACP es reutilizado para realizar la reacción de eloganción del malonil-CoA, que después de 3 ciclos forma Octanoil-ACP.
8. El octanoil-ACP se transfere a una lisina por la octanoil transferasa, formando ácido octanoico.
9. El ácido octanoico es sulfurado en las posiciones 6 y 8 por la AL sintetasa produciendo el enantiómero R-LA
10. Finalmente el residuo de AL es transferido a residuos de lisina del complejo E2 catalizado por la lipoil-transferasa.[30][31]
Enfermedades
[editar]Aciduria malónica y metilmalónica combinada (CMAMMA)
[editar]En la enfermedad metabólica aciduria malónica y metilmalónica combinada (CMAMMA) debida a la deficiencia de ACSF3, la síntesis mitocondrial de ácidos grasos (mtFASII), que es la reacción precursora de la biosíntesis del ácido lipoico, está alterada.[40][41] El resultado es un nivel reducido de lipoilación de importantes enzimas mitocondriales como el complejo piruvato deshidrogenasa (PDC) y el complejo α-cetoglutarato deshidrogenasa (α-KGDH).[41] La suplementación con ácido lipoico no restaura la función mitocondrial.[42][41]
Farmacología del ácido lipoico
[editar]Farmacocinética
[editar]Un estudio de 2007 de farmacocinética humana de RLA de sodio demostró que la concentración máxima en plasma y la biodisponibilidad son significativamente mayores que la forma de ácido libre, y compite con los niveles plasmáticos alcanzados por la administración intravenosa de la forma de ácido libre. Además, se han conseguido niveles plasmáticos elevados comparables a los de los modelos animales donde se activó Nrf2.[43]
Las diversas formas de LA no son bioequivalentes.[32] Hay muy pocos estudios que comparen enantiómeros individuales con el ácido lipoico racémico. No está claro si el doble de ácido lipoico racémico puede reemplazar al RLA.[44]
La dosis tóxica de LA en los gatos es mucho menor que en los seres humanos o perros y produce toxicidad hepatocelular.[45]
Farmacodinámica
[editar]El mecanismo y la acción del ácido lipóico cuando se suministra externamente a un organismo es motivo de controversia. El ácido lipóico induce la respuesta al estrés oxidativo en lugar de recoger directamente los radicales libres. Este efecto es específico para RLA.[3] A pesar del medio reductor, el LA ha sido detectado intracelularmente en formas tanto oxidadas y reducidas.[46] El LA es capaz de barrer el oxígeno reactivo y especies reactivas de nitrógeno en un ensayo bioquímico debido a largos tiempos de incubación, pero hay poca evidencia de esto se produzca dentro de una célula o que la captación de radicales contribuya a los mecanismos primarios de acción del LA.[3][47] La buena capacidad de eliminación de LA hacia el ácido hipocloroso (un bactericida producida por los neutrófilos que pueden producir inflamación y daño tisular) se debe a la conformación tensa del anillo ditiolano de 5 miembros, que se pierde después de la reducción a DHLA. En las células, el LA se reduce a ácido dihidrolipoico, que generalmente se considera como la forma más bioactiva de LA y la forma responsable de la mayoría de los efectos antioxidantes.[48] Esta teoría ha sido cuestionada debido al alto nivel de reactividad de los dos sulfhidrilos libres, por las bajas concentraciones intracelulares de DHLA, así como el rápido metilación de uno o ambos sulfhidrilos, también la rápida oxidación de la cadena lateral a metabolitos más cortos y el rápido flujo de salida de la célula. Aunque tanto el DHLA y el LA se han encontrado en el interior de las células después de la administración, la mayor parte intracelular de DHLA probablemente exista como disulfuros mixtos con diferentes residuos de cisteína de las proteínas mitocondriales y citosólicas. Recientes hallazgos sugieren que los efectos terapéuticos y antienvejecimiento se deben a la modulación de la transducción de señales y la transcripción de genes, lo que mejora el estado antioxidante de la célula. Sin embargo, esto probablemente se produce a través de mecanismos pro-oxidantes, no por barrido de radicales o la reducción los efectos.[49][50]
Todas las formas de disulfuro de LA (R / S-LA, RLA y SLA) se pueden reducir a DHLA aunque ambos tejidos son específicos y estereoselectiva (preferencia por un enantiómero sobre el otro) reducciones han sido reportados en sistemas modelo. Al menos dos enzimas citosólicas, glutatión reductasa (GR) y la tiorredoxina reductasa (TRX1), y dos enzimas mitocondriales,lipoamida deshidrogenasa y la tiorredoxina reductasa (Trx2), reducen el LA. El SLA se reduce estereoselectivamente por citosólica GR mientras que TRX1, Trx2 y lipoamida deshidrogenasa estereoselectiva reduce RLA. (R) - (+) - el ácido lipoico se reduce enzimáticamente o químicamente a (R) - (-) - ácido dihidrolipoico mientras que (S) - (-) - ácido lipoico se reduce a (S) - (+) - ácido dihidrolipoico.[51][52][53][54][55][56][57] El ácido dihidrolipoico (DHLA) también puede formar intracelularmente y extracelularmente vía no enzimática, reacciones de intercambio de tiol-disulfuro.[58]
El RLA puede funcionar “in vivo” como una vitamina B y en dosis más altas como nutrientes de origen vegetal, tales como la curcumina, el sulforafano, el resveratrol, y otras sustancias nutricionales que induce las enzimas de fase II de desintoxicación, actuando así como agentes citoprotectores.[59] Esta respuesta de estrés mejora indirectamente la capacidad antioxidante de la célula.
El enantiómero (S) de LA ha demostrado ser tóxico cuando se administra a ratas con deficiencia de tiamina.[60][61]
Varios estudios han demostrado que el SLA o bien tiene una actividad más baja que RLA o interfiere con los efectos específicos de RLA por inhibición competitiva.[62][63][64][65]
Usos
[editar]R/S-LA y RLA están disponibles como suplementos nutricionales en los Estados Unidos en forma de cápsulas, tabletas y líquidos acuosos, y se han comercializado como antioxidantes (Por ejemplo, ayuda a la regeneración de la vitamina C y E, por ello se dice que es un buen antioxidante).[66] Esta etiqueta ha sido recientemente cuestionada.[3] En Japón, LA se comercializa principalmente como un producto que ayuda a perder peso y como suplemento de energía. Las relaciones entre dosis suplementarias y dosis terapéuticas no se han definido claramente. El ácido lipoico no es un nutriente esencial, no ha sido establecido por “Recommended Daily Allowance” (RDA). En Alemania, el LA está aprobado como un fármaco contra la diabetes comorbilidades desde 1966 y se encuentra disponible con receta médica.[67]
El LA se utiliza también para diversos casos, tales como enfermedades de hígado o de riñón.
Algunos estudios han indicado que el LA puede ser beneficioso para el corazón o los riñones de personas hipertensas, lo cual es indicativo de que es un gran antioxidante.[68]
Por otro lado, el LA puede aumentar, según algunos estudios, la síntesis de glutatión (un importante antioxidante intracelular) mediante el aumento de la expresión de γ-glutamilcisteína de la ligasa (GCL), la limitante de la velocidad de la enzima en la síntesis de glutatión y mediante el aumento de la captación celular de cisteína, un aminoácido necesario para la síntesis de glutatión.[4]
Investigación clínica
[editar]-Según la "American Cancer Society", "no hay evidencia científica confiable en este momento que diga que el ácido lipoico previene el desarrollo o expansión del cáncer". A pesar de ello existen algunos estudios que afirman que el ácido lipoico puede inhibir la proliferación de algunos tumores (como el del cáncer de mama o el de colon). Por otro lado, otros estudios aseguran que puede llegar a ser nocivo para diversos tipos de cáncer como el anteriormente mencionado, cáncer de colon. Por ello se dice que la evidencia no es suficiente como para asegurar que el LA actúa contra el cáncer.[69]
-Para la neuropatía diabética periférica, la administración intravenosa de ácido alfa-lipoico conduce a una mejora a corto plazo, pero no hay una gran evidencia de un beneficio significativo cuando se toma por vía oral.[70]
-Una revisión literaria, utilizando los estudios disponibles desde enero de 2008, no logró encontrar ensayos controlados aleatorizados utilizando ácido lipoico para el tratamiento de la demencia. Debido a la ausencia de evidencias no se pudo apoyar el uso del ácido lipoico para el tratamiento de ninguna de las formas de demencia.[70] A pesar de ello, existen estudios que indican la posibilidad de que el ácido lipoico sea una opción de tratamiento para el alzheimer y otras demencias.[71]
-Hay una ligera evidencia de que el ácido lipoico puede ayudar al control del síndrome de la boca ardiente, aunque algunos estudios también han indicado que para el tratamiento del síndrome hace falta complementar el ácido lipoico con tratamiento psicológico.
-No hay evidencia de que el ácido alfa lipoico ayude a las personas con trastornos mitocondriales.[72]
-Hay una limitada evidencia de que el ácido lipoico pueda tener potencial como fármaco para el tratamiento de la esclerosis múltiple.[73]
Efectos clínicos adversos
[editar]Los efectos secundarios del ácido alfa lipoico pueden incluir dolor de cabeza, sensación de hormigueo, erupciones en la piel o calambres musculares. Ha habido algunos informes en Japón de un caso extraño conocido como síndrome autoinmune a la insulina en personas que utilizan el ácido alfa lipoico.[74] Esta condición provoca hipoglucemia y hace que los anticuerpos ataquen a la insulina producida por el organismo sin haber tenido tratamiento con insulina previamente.
La seguridad del ácido alfa lipoico en mujeres embarazadas o lactantes, niños o personas con enfermedades hepáticas o renales es desconocida.
Aparte de los ya anteriormente mencionados, hay estudios que afirman que el ácido lipoico puede tener otros efectos adversos, tales como urticaria, dolor abdominal, náuseas, diarrea y vómitos, además de orina maloliente. Estos efectos son dependientes de la dosis de ácido lipoico que sea suministrada y de la vía de suministro.[4]
Otros ácidos lipoicos
[editar]El ácido beta-lipoico es tiosulfinato de un ácido α-lipoico.
El ácido dihidrolipoico y el ácido DL-alfa-lipoico reducido son otras formas de ácido lipoico que actúan como compuestos activadores.[75]
Referencias
[editar]- ↑ Número CAS
- ↑ Petersen Shay, Kate; Moreau, Régis F.; Smith, Eric J.; Hagen, Tory M. (1 de junio de 2008). «Is α-lipoic acid a scavenger of reactive oxygen species in vivo? Evidence for its initiation of stress signaling pathways that promote endogenous antioxidant capacity». IUBMB Life (en inglés) 60 (6): 362-367. ISSN 1521-6551. doi:10.1002/iub.40. Consultado el 21 de octubre de 2016.
- ↑ a b c d Reljanovic, M.; Reichel, G.; Rett, K.; Lobisch, M.; Schuette, K.; Möller, W.; Tritschler, H.-J.; Mehnert, H. (1 de enero de 1999). «Treatment of diabetic polyneuropathy with the antioxidant thioctic acid (α-lipoic acid): A two year multicenter randomized double-blind placebo-controlled trial (ALADIN II)». Free Radical Research 31 (3): 171-179. ISSN 1071-5762. PMID 10499773. doi:10.1080/10715769900300721. Consultado el 23 de octubre de 2016.
- ↑ a b c d «Lipoic Acid». Linus Pauling Institute. 28 de abril de 2014. Consultado el 23 de octubre de 2016.
- ↑ Raddatz, G; Bisswanger, H (17 de octubre de 1997). «Receptor site and stereospecifity of dihydrolipoamide dehydrogenase for R- and S-lipoamide: a molecular modeling study». Journal of Biotechnology 58 (2): 89-100. doi:10.1016/S0168-1656(97)00135-1. Consultado el 21 de octubre de 2016.
- ↑ Cronan, John E.; Fearnley, Ian M.; Walker, John E. (29 de agosto de 2005). «Mammalian mitochondria contain a soluble acyl carrier protein». FEBS Letters (en inglés) 579 (21): 4892-4896. ISSN 1873-3468. doi:10.1016/j.febslet.2005.07.077. Consultado el 21 de octubre de 2016.
- ↑ Jordan, Sean W.; Cronan, John E. (18 de julio de 1997). «A New Metabolic Link THE ACYL CARRIER PROTEIN OF LIPID SYNTHESIS DONATES LIPOIC ACID TO THE PYRUVATE DEHYDROGENASE COMPLEX IN ESCHERICHIA COLIAND MITOCHONDRIA». Journal of Biological Chemistry (en inglés) 272 (29): 17903-17906. ISSN 0021-9258. doi:10.1074/jbc.272.29.17903. Consultado el 21 de octubre de 2016.
- ↑ Cicchillo, Robert M.; Booker, Squire J. (9 de marzo de 2005). «Mechanistic Investigations of Lipoic Acid Biosynthesis in Escherichia coli: Both Sulfur Atoms in Lipoic Acid are Contributed by the Same Lipoyl Synthase Polypeptide». Journal of the American Chemical Society 127 (9): 2860-2861. ISSN 0002-7863. doi:10.1021/ja042428u. Consultado el 21 de octubre de 2016.
- ↑ Jiang, Yanfang; Cronan, John E. (21 de enero de 2005). «Expression cloning and demonstration of Enterococcus faecalis lipoamidase (pyruvate dehydrogenase inactivase) as a Ser-Ser-Lys triad amidohydrolase». The Journal of Biological Chemistry 280 (3): 2244-2256. ISSN 0021-9258. PMID 15528186. doi:10.1074/jbc.M408612200. Consultado el 23 de octubre de 2016.
- ↑ Cronan, John E.; Zhao, Xin; Jiang, Yanfang (1 de enero de 2005). Poole, Robert K., ed. Function, Attachment and Synthesis of Lipoic Acid in Escherichia coli 50. Academic Press. pp. 103-146. Consultado el 21 de octubre de 2016.
- ↑ DrugBank, ed. (17 de agosto de 2016). «Lipoic Acid». DrugBank. Consultado el 23 de octubre de 2016.
- ↑ Milne, Jacqueline L. S.; Wu, Xiongwu; Borgnia, Mario J.; Lengyel, Jeffrey S.; Brooks, Bernard R.; Shi, Dan; Perham, Richard N.; Subramaniam, Sriram (17 de febrero de 2006). «Molecular Structure of a 9-MDa Icosahedral Pyruvate Dehydrogenase Subcomplex Containing the E2 and E3 Enzymes Using Cryoelectron Microscopy». The Journal of biological chemistry 281 (7): 4364-4370. ISSN 0021-9258. PMC 1647297. PMID 16308322. doi:10.1074/jbc.M504363200. Consultado el 21 de octubre de 2016.
- ↑ Machado, Rosane S.; Clark, David P.; Guest, John R. «Construction and properties of pyruvate dehydrogenase complexes with up to nine lipoyl domains per lipoate acetyltransferase chain». FEMS Microbiology Letters 100 (1-3): 243-248. doi:10.1111/j.1574-6968.1992.tb05710.x.
- ↑ Douce, Roland; Bourguignon, Jacques; Neuburger, Michel; Rébeillé, Fabrice. «The glycine decarboxylase system: a fascinating complex». Trends in Plant Science 6 (4): 167-176. doi:10.1016/s1360-1385(01)01892-1.
- ↑ Durrani, Arjumand I.; Schwartz, Heidi; Nagl, Michael; Sontag, Gerhard (15 de junio de 2010). «Determination of free α-lipoic acid in foodstuffs by HPLC coupled with CEAD and ESI-MS». Food Chemistry 120 (4): 1143-1148. doi:10.1016/j.foodchem.2009.11.045. Consultado el 23 de octubre de 2016.
- ↑ «European Journal of Pharmaceutical Sciences»
|url=incorrecta con autorreferencia (ayuda). Wikipedia (en inglés). 11 de julio de 2016. Consultado el 23 de octubre de 2016. - ↑ Teichert, Jens; Preiss, Rainer (1 de enero de 1997). Enzymology, BT - Methods in, ed. [17] High-performance liquid chromatography methods for determination of lipoic and dihydrolipoic acid in human plasma. Vitamins and Coenzymes Part I 279. Academic Press. pp. 159-166. doi:10.1016/s0076-6879(97)79019-0. Consultado el 23 de octubre de 2016.
- ↑ Teichert, Jens; Preiß, Rainer (20 de octubre de 1995). «Determination of lipoic acid in human plasma by high-performance liquid chromatography with electrochemical detection». Journal of Chromatography B: Biomedical Sciences and Applications 672 (2): 277-281. doi:10.1016/0378-4347(95)00225-8. Consultado el 23 de octubre de 2016.
- ↑ Teichert, J.; Preiss, R. (1 de noviembre de 1992). «HPLC-methods for determination of lipoic acid and its reduced form in human plasma». International Journal of Clinical Pharmacology, Therapy, and Toxicology 30 (11): 511-512. ISSN 0174-4879. PMID 1490813. Consultado el 23 de octubre de 2016.
- ↑ Biewenga, Gerreke Ph.; Haenen, Guido R. M. M.; Bast, Aalt (1 de septiembre de 1997). «The pharmacology of the antioxidant lipoic acid». General Pharmacology: The Vascular System 29 (3): 315-331. doi:10.1016/S0306-3623(96)00474-0. Consultado el 23 de octubre de 2016.
- ↑ Wada, M.; Shigeta, Y.; Inamori, K. (10 de septiembre de 1961). «A study on the metabolism of lipoic acid and lipoamide». The Journal of Vitaminology 7: 237-242. ISSN 0022-5398. PMID 14004240. Consultado el 23 de octubre de 2016.
- ↑ Oizumi, J.; Hayakawa, K. (31 de julio de 1989). «Liberation of lipoate by human serum lipoamidase from bovine heart pyruvate dehydrogenase». Biochemical and Biophysical Research Communications 162 (2): 658-663. ISSN 0006-291X. PMID 2502979. Consultado el 23 de octubre de 2016.
- ↑ SAITO, Jun-itsu (1 de enero de 1960). «THE CONVERSION OF THIOCTAMIDE TO THIOCTIC ACID IN BIOLOGICAL SYSTEM : (I) STUDIES ON THE THIOCTIC ACID ACTIVE SUBSTANCES IN RABBITS SERUM AFTER THE ADMINISTRATION OF THIOCTAMIDE». Vitamins 21: 359-363. ISSN 0006-386X. Consultado el 23 de octubre de 2016.
- ↑ Backman-Gullers, B.; Hannestad, U.; Nilsson, L.; Sörbo, B. (31 de octubre de 1990). «Studies on lipoamidase: characterization of the enzyme in human serum and breast milk». Clinica Chimica Acta; International Journal of Clinical Chemistry 191 (1-2): 49-60. ISSN 0009-8981. PMID 2127386. Consultado el 23 de octubre de 2016.
- ↑ Garganta, C. L.; Wolf, B. (31 de agosto de 1990). «Lipoamidase activity in human serum is due to biotinidase». Clinica Chimica Acta; International Journal of Clinical Chemistry 189 (3): 313-325. ISSN 0009-8981. PMID 2225462. Consultado el 23 de octubre de 2016.
- ↑ Shih, J. C.; Rozo, M. L.; Wright, L. D.; McCormick, D. B. (1 de febrero de 1975). «Characterization of the growth of Pseudomonas putida LP on lipoate and its analogues: transport, oxidation, sulphur source, and enzyme induction». Journal of General Microbiology 86 (2): 217-227. ISSN 0022-1287. PMID 1089758. doi:10.1099/00221287-86-2-217. Consultado el 23 de octubre de 2016.
- ↑ Mansilla, M. C.; de Mendoza, D. (1 de febrero de 1997). «L-cysteine biosynthesis in Bacillus subtilis: identification, sequencing, and functional characterization of the gene coding for phosphoadenylylsulfate sulfotransferase». Journal of Bacteriology 179 (3): 976-981. ISSN 0021-9193. PMC 178787. PMID 9006060. Consultado el 23 de octubre de 2016.
- ↑ a b Schupke, H.; Hempel, R.; Peter, G.; Hermann, R.; Wessel, K.; Engel, J.; Kronbach, T. (1 de junio de 2001). «New metabolic pathways of alpha-lipoic acid». Drug Metabolism and Disposition: The Biological Fate of Chemicals 29 (6): 855-862. ISSN 0090-9556. PMID 11353754. Consultado el 23 de octubre de 2016.
- ↑ Teichert, Jens; Hermann, Robert; Ruus, Peter; Preiss, Rainer (1 de noviembre de 2003). «Plasma kinetics, metabolism, and urinary excretion of alpha-lipoic acid following oral administration in healthy volunteers». Journal of Clinical Pharmacology 43 (11): 1257-1267. ISSN 0091-2700. PMID 14551180. doi:10.1177/0091270003258654. Consultado el 23 de octubre de 2016.
- ↑ a b Hornberger, Carl S.; Heitmiller, Richard F.; Gunsalus, I. C.; Schnakenberg, G. H. F.; Reed, Lester J. (1 de marzo de 1953). «Synthesis of DL-α-Lipoic Acid». Journal of the American Chemical Society 75 (6): 1273-1277. ISSN 0002-7863. doi:10.1021/ja01102a003. Consultado el 23 de octubre de 2016.
- ↑ a b Hornberger, Carl S.; Heitmiller, Richard F.; Gunsalus, I. C.; Schnakenberg, G. H. F.; Reed, Lester J. (1 de mayo de 1952). «SYNTHETIC PREPARATION OF LIPOIC ACID». Journal of the American Chemical Society 74 (9): 2382-2382. ISSN 0002-7863. doi:10.1021/ja01129a511. Consultado el 23 de octubre de 2016.
- ↑ a b «Book sources»
|url=incorrecta con autorreferencia (ayuda). Wikipedia (en inglés). Consultado el 23 de octubre de 2016. - ↑ Fontanella, L. (1 de enero de 1955). «[Preparation of optical antipodes of alpha-lipoic acid]». Il Farmaco; Edizione Scientifica 10 (12): 1043-1045. ISSN 0430-0920. PMID 13294188. Consultado el 23 de octubre de 2016.
- ↑ Walton, Edward; Wagner, Arthur F.; Bachelor, Frank W.; Peterson, Louis H.; Holly, Frederick W.; Folkers, Karl (1 de octubre de 1955). «Synthesis of (+)-α-Lipoic Acid and its Optical Antipode1». Journal of the American Chemical Society 77 (19): 5144-5149. ISSN 0002-7863. doi:10.1021/ja01624a057. Consultado el 23 de octubre de 2016.
- ↑ Acker, D. S.; Wayne, W. J. (1 de diciembre de 1957). «Synthesis of Racemic, Optically Active and Radioactive α-Lipoic Acids». Journal of the American Chemical Society 79 (24): 6483-6487. ISSN 0002-7863. doi:10.1021/ja01581a033. Consultado el 23 de octubre de 2016.
- ↑ Deguchi, Y.; Miura, K. (1 de junio de 1964). «[STUDIES ON THE SYNTHESIS OF THIOCTIC ACID AND ITS RELATED COMPOUNDS. XIV. SYNTHESIS OF (+)-THIOCTAMIDE]». Yakugaku Zasshi: Journal of the Pharmaceutical Society of Japan 84: 562-563. ISSN 0031-6903. PMID 14207116. Consultado el 23 de octubre de 2016.
- ↑ «Espacenet - Bibliographic data». worldwide.espacenet.com. Consultado el 23 de octubre de 2016.
- ↑ «Lipoic acid»
|url=incorrecta con autorreferencia (ayuda). Wikipedia (en inglés). 16 de septiembre de 2016. Consultado el 23 de octubre de 2016. - ↑ Packer, Lester; Kraemer, Klaus; Rimbach, Gerald. «Molecular aspects of lipoic acid in the prevention of diabetes complications». Nutrition 17 (10): 888-895. doi:10.1016/s0899-9007(01)00658-x.
- ↑ Levtova, Alina; Waters, Paula J.; Buhas, Daniela; Lévesque, Sébastien; Auray‐Blais, Christiane; Clarke, Joe T.R.; Laframboise, Rachel; Maranda, Bruno et al. (2019-01). «Combined malonic and methylmalonic aciduria due to ACSF3 mutations: Benign clinical course in an unselected cohort». Journal of Inherited Metabolic Disease (en inglés) 42 (1): 107-116. ISSN 0141-8955. doi:10.1002/jimd.12032.
- ↑ a b c Wehbe, Zeinab; Behringer, Sidney; Alatibi, Khaled; Watkins, David; Rosenblatt, David; Spiekerkoetter, Ute; Tucci, Sara (2019-11). «The emerging role of the mitochondrial fatty-acid synthase (mtFASII) in the regulation of energy metabolism». Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids (en inglés) 1864 (11): 1629-1643. doi:10.1016/j.bbalip.2019.07.012.
- ↑ Hiltunen, J. Kalervo; Autio, Kaija J.; Schonauer, Melissa S.; Kursu, V.A. Samuli; Dieckmann, Carol L.; Kastaniotis, Alexander J. (2010-06). «Mitochondrial fatty acid synthesis and respiration». Biochimica et Biophysica Acta (BBA) - Bioenergetics (en inglés) 1797 (6-7): 1195-1202. doi:10.1016/j.bbabio.2010.03.006.
- ↑ Carlson, DA; Smith, AR; Fischer, SJ; Young, KL; et al. (December 2007). «Alternative Medicine Review». Archivado desde el original el 8 de agosto de 2017.
- ↑ Carlson, David A.; Smith, Anthony R.; Fischer, Sarah J.; Young, Karyn L.; Packer, Lester (1 de diciembre de 2007). «The plasma pharmacokinetics of R-(+)-lipoic acid administered as sodium R-(+)-lipoate to healthy human subjects». Alternative Medicine Review: A Journal of Clinical Therapeutic 12 (4): 343-351. ISSN 1089-5159. PMID 18069903. Consultado el 23 de octubre de 2016.
- ↑ Hill, A. S.; Werner, J. A.; Rogers, Q. R.; O'Neill, S. L.; Christopher, M. M. (1 de abril de 2004). «Lipoic acid is 10 times more toxic in cats than reported in humans, dogs or rats». Journal of Animal Physiology and Animal Nutrition 88 (3-4): 150-156. ISSN 0931-2439. PMID 15059240. doi:10.1111/j.1439-0396.2003.00472.x. Consultado el 23 de octubre de 2016.
- ↑ Packer, L.; Witt, E. H.; Tritschler, H. J. (1 de agosto de 1995). «alpha-Lipoic acid as a biological antioxidant». Free Radical Biology & Medicine 19 (2): 227-250. ISSN 0891-5849. PMID 7649494. Consultado el 23 de octubre de 2016.
- ↑ Shay, Kate Petersen; Moreau, Régis F.; Smith, Eric J.; Smith, Anthony R.; Hagen, Tory M. (1 de octubre de 2009). «Alpha-lipoic acid as a dietary supplement: molecular mechanisms and therapeutic potential». Biochimica Et Biophysica Acta 1790 (10): 1149-1160. ISSN 0006-3002. PMC 2756298. PMID 19664690. doi:10.1016/j.bbagen.2009.07.026. Consultado el 23 de octubre de 2016.
- ↑ Haenen, G. R.; Bast, A. (6 de noviembre de 1991). «Scavenging of hypochlorous acid by lipoic acid». Biochemical Pharmacology 42 (11): 2244-2246. ISSN 0006-2952. PMID 1659823. Consultado el 23 de octubre de 2016.
- ↑ Haenen, Guido R. M. M.; Bast, Aalt (6 de noviembre de 1991). «Scavenging of hypochlorous acid by lipoic acid». Biochemical Pharmacology 42 (11): 2244-2246. doi:10.1016/0006-2952(91)90363-A. Consultado el 23 de octubre de 2016.
- ↑ Shay, Kate Petersen; Moreau, Régis F.; Smith, Eric J.; Smith, Anthony R.; Hagen, Tory M. (23 de octubre de 2016). «Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential». Biochimica et biophysica acta 1790 (10): 1149-1160. ISSN 0006-3002. PMC 2756298. PMID 19664690. doi:10.1016/j.bbagen.2009.07.026. Consultado el 23 de octubre de 2016.
- ↑ Arnér, E. S.; Nordberg, J.; Holmgren, A. (5 de agosto de 1996). «Efficient reduction of lipoamide and lipoic acid by mammalian thioredoxin reductase». Biochemical and Biophysical Research Communications 225 (1): 268-274. ISSN 0006-291X. PMID 8769129. doi:10.1006/bbrc.1996.1165. Consultado el 23 de octubre de 2016.
- ↑ Biaglow, John E.; Ayene, Iraimoudi S.; Koch, Cameron J.; Donahue, Jeremiah; Stamato, Thomas D.; Mieyal, John J.; Tuttle, Stephen W. (1 de abril de 2003). «Radiation response of cells during altered protein thiol redox». Radiation Research 159 (4): 484-494. ISSN 0033-7587. PMID 12643793. Consultado el 23 de octubre de 2016.
- ↑ Haramaki, N.; Han, D.; Handelman, G. J.; Tritschler, H. J.; Packer, L. (1 de enero de 1997). «Cytosolic and mitochondrial systems for NADH- and NADPH-dependent reduction of alpha-lipoic acid». Free Radical Biology & Medicine 22 (3): 535-542. ISSN 0891-5849. PMID 8981046. Consultado el 23 de octubre de 2016.
- ↑ Constantinescu, A.; Pick, U.; Handelman, G. J.; Haramaki, N.; Han, D.; Podda, M.; Tritschler, H. J.; Packer, L. (17 de julio de 1995). «Reduction and transport of lipoic acid by human erythrocytes». Biochemical Pharmacology 50 (2): 253-261. ISSN 0006-2952. PMID 7632170. Consultado el 23 de octubre de 2016.
- ↑ May, James M.; Qu, Zhi-chao; Nelson, Deanna J. (16 de junio de 2006). «Cellular disulfide-reducing capacity: an integrated measure of cell redox capacity». Biochemical and Biophysical Research Communications 344 (4): 1352-1359. ISSN 0006-291X. PMID 16650819. doi:10.1016/j.bbrc.2006.04.065. Consultado el 23 de octubre de 2016.
- ↑ Jones, Wright; Li, Xia; Qu, Zhi-chao; Perriott, Laureta; Whitesell, Richard R.; May, James M. (1 de julio de 2002). «Uptake, recycling, and antioxidant actions of alpha-lipoic acid in endothelial cells». Free Radical Biology & Medicine 33 (1): 83-93. ISSN 0891-5849. PMID 12086686. Consultado el 23 de octubre de 2016.
- ↑ Schempp, H.; Ulrich, H.; Elstner, E. F. (1 de octubre de 2016). «Stereospecific reduction of R(+)-thioctic acid by porcine heart lipoamide dehydrogenase/diaphorase». Zeitschrift Fur Naturforschung. C, Journal of Biosciences 49 (9-10): 691-692. ISSN 0939-5075. PMID 7945680. Consultado el 23 de octubre de 2016.
- ↑ Petersen Shay, Kate; Moreau, Régis F.; Smith, Eric J.; Hagen, Tory M. (1 de junio de 2008). «Is α-lipoic acid a scavenger of reactive oxygen species in vivo? Evidence for its initiation of stress signaling pathways that promote endogenous antioxidant capacity». IUBMB Life (en inglés) 60 (6): 362-367. ISSN 1521-6551. doi:10.1002/iub.40. Consultado el 23 de octubre de 2016.
- ↑ Lii, Chong-Kuei; Liu, Kai-Li; Cheng, Yi-Ping; Lin, Ai-Hsuan; Chen, Haw-Wen; Tsai, Chia-Wen (1 de mayo de 2010). «Sulforaphane and alpha-lipoic acid upregulate the expression of the pi class of glutathione S-transferase through c-jun and Nrf2 activation». The Journal of Nutrition 140 (5): 885-892. ISSN 1541-6100. PMID 20237067. doi:10.3945/jn.110.121418. Consultado el 23 de octubre de 2016.
- ↑ Gal, E. M.; Razevska, D. E. (1 de agosto de 1960). «Studies on the in vivo metabolism of lipoic acid. 1. The fate of DL-lipoic acid-S35 in normal and thiamine-deficient rats». Archives of Biochemistry and Biophysics 89: 253-261. ISSN 0003-9861. PMID 13825981. Consultado el 23 de octubre de 2016.
- ↑ Gal, E. M. (31 de julio de 1965). «Reversal of selective toxicity of (-)-alpha-lipoic acid by thiamine in thiamine-deficient rats». Nature 207 (996): 535. ISSN 0028-0836. PMID 5328673. Consultado el 23 de octubre de 2016.
- ↑ «Espacenet - Bibliographic data». worldwide.espacenet.com. Consultado el 23 de octubre de 2016.
- ↑ «36th Annual meeting of the European Association for the Study of Diabetes. Jerusalem, Israel, 17-21 September 2000. Abstracts». Diabetologia. 43 Suppl 1: A1-316. 1 de agosto de 2000. ISSN 0012-186X. PMID 11008622. Consultado el 23 de octubre de 2016.
- ↑ Streeper, R. S.; Henriksen, E. J.; Jacob, S.; Hokama, J. Y.; Fogt, D. L.; Tritschler, H. J. (1 de julio de 1997). «Differential effects of lipoic acid stereoisomers on glucose metabolism in insulin-resistant skeletal muscle». The American Journal of Physiology 273 (1 Pt 1): E185-191. ISSN 0002-9513. PMID 9252495. Consultado el 23 de octubre de 2016.
- ↑ Frölich, L.; Götz, M. E.; Weinmüller, M.; Youdim, M. B. H.; Barth, N.; Dirr, A.; Gsell, W.; Jellinger, K. et al. (1 de marzo de 2004). «(r)-, but not (s)-alpha lipoic acid stimulates deficient brain pyruvate dehydrogenase complex in vascular dementia, but not in Alzheimer dementia». Journal of Neural Transmission (Vienna, Austria: 1996) 111 (3): 295-310. ISSN 0300-9564. PMID 14991456. doi:10.1007/s00702-003-0043-5. Consultado el 23 de octubre de 2016.
- ↑ «Ácido alfa lipoico propiedades y contraindicaciones». Ácido Hialurónico. 6 de mayo de 2015. Consultado el 23 de octubre de 2016.
- ↑ Ziegler, D.; Reljanovic, M.; Mehnert, H.; Gries, F. A. (1 de enero de 1999). «Alpha-lipoic acid in the treatment of diabetic polyneuropathy in Germany: current evidence from clinical trials». Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association 107 (7): 421-430. ISSN 0947-7349. PMID 10595592. doi:10.1055/s-0029-1212132. Consultado el 23 de octubre de 2016.
- ↑ Tayebati, Seyed Khosrow; Tomassoni, Daniele; Di Cesare Mannelli, Lorenzo; Amenta, Francesco (1 de enero de 2016). «Effect of treatment with the antioxidant alpha-lipoic (thioctic) acid on heart and kidney microvasculature in spontaneously hypertensive rats». Clinical and Experimental Hypertension (New York, N.Y.: 1993) 38 (1): 30-38. ISSN 1525-6006. PMID 26207883. doi:10.3109/10641963.2015.1047950. Consultado el 23 de octubre de 2016.
- ↑ El-Gowelli, Hanan M.; Saad, Evan I.; Abdel-Galil, Abdel-Galil A.; Ibrahim, Einas R. (1 de noviembre de 2015). «Co-administration of α-lipoic acid and cyclosporine aggravates colon ulceration of acetic acid-induced ulcerative colitis via facilitation of NO/COX-2/miR-210 cascade». Toxicology and Applied Pharmacology 288 (3): 300-312. ISSN 1096-0333. PMID 26276312. doi:10.1016/j.taap.2015.08.002. Consultado el 23 de octubre de 2016.
- ↑ a b Mijnhout, Gerritje S.; Kollen, Boudewijn J.; Alkhalaf, Alaa; Kleefstra, Nanno; Bilo, Henk J. G. (1 de enero de 2012). «Alpha Lipoic Acid for Symptomatic Peripheral Neuropathy in Patients with Diabetes: A Meta-Analysis of Randomized Controlled Trials». International Journal of Endocrinology 2012. ISSN 1687-8337. PMC 3272801. PMID 22331979. doi:10.1155/2012/456279. Consultado el 23 de octubre de 2016.
- ↑ «Alpha-lipoic acid as a new treatment option for Azheimer type dementia». www.sciencedirect.com. Consultado el 23 de octubre de 2016.
- ↑ Pfeffer, Gerald; Majamaa, Kari; Turnbull, Douglass M; Thorburn, David; Chinnery, Patrick F (18 de abril de 2012). Treatment for mitochondrial disorders (en inglés). John Wiley & Sons, Ltd. ISBN 14651858
|isbn=incorrecto (ayuda). doi:10.1002/14651858.cd004426.pub3/abstract;jsessionid=7aa79d0eb2d19f4bbfbeb88f8107813b.f03t03. Consultado el 23 de octubre de 2016. - ↑ «Lipoic Acid: A Novel Therapeutic Approach for Multiple Sclerosis and Other Chronic Inflammatory Diseases of the CNS». http://www.eurekaselect.com. Consultado el 23 de octubre de 2016.
- ↑ Ishida, Yoshihiko; Ohara, Takeshi; Okuno, Yoko; Ito, Tatsuo; Hirota, Yushi; Furukawa, Kensuke; Sakaguchi, Kazuhiko; Ogawa, Wataru et al. (1 de septiembre de 2007). «α-Lipoic Acid and Insulin Autoimmune Syndrome». Diabetes Care (en inglés) 30 (9): 2240-2241. ISSN 0149-5992. PMID 17586737. doi:10.2337/dc07-0689. Consultado el 23 de octubre de 2016.
- ↑ «BRENDA - Search Result». www.brenda-enzymes.org. Consultado el 23 de octubre de 2016.
