Proceso politrópico
Se denomina proceso politrópico al proceso termodinámico, generalmente ocurrido en gases, en el que existe, tanto una transferencia de energía al interior del sistema que contiene el o los gases como una transferencia de energía con el medio exterior.[1]
El proceso politrópico obedece a la relación:
Donde p es la presión, V es un volumen específico, n, el índice politrópico, que puede ser cualquier número real, y C es una constante. La ecuación de un proceso politrópico es particularmente útil para describir los procesos de expansión y compresión que incluyen transferencia de calor. Esta ecuación puede caracterizar un amplio rango de procesos termodinámicos desde n=0 a n= lo cual incluye: n=0 (proceso isobárico), n=1 (proceso isotérmico), n=γ (proceso isentrópico), n= (proceso isocórico) y todos los valores intermedios de n. Así la ecuación es politrópica en el sentido de que describe varias líneas o procesos. Además de la representación del comportamiento de gases, la ecuación puede ser utilizada para representar ciertos comportamientos de líquidos o sólidos. La única restricción es que el proceso debe desplegar una tasa de transferencia de energía de K=δQ/δW=constante durante tal proceso. Si se desvía de tal restricción, esto sugiere que el exponente no es una constante. Para un exponente específico, otros puntos a lo largo de la curva pueden ser calculados de la siguiente manera:
Derivación
[editar]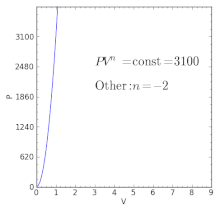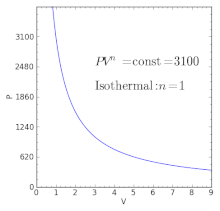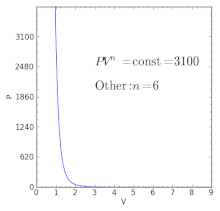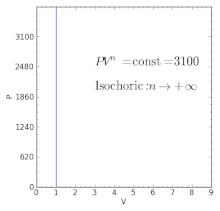
La siguiente derivación es tomada del texto de Joseph Christians.[2] Considérese un gas en un sistema cerrado bajo un proceso interno reversible con cambios insignificantes de energía cinética y potencial. El primer principio de la termodinámica establece que:
Donde q es positiva por el calor añadido al sistema y w es negativa para el trabajo realizado por el sistema.
Al definir el índice de transferencia de energía se tiene:
- .
Para un proceso interno reversible el único tipo de interacción de trabajo es el desplazamiento de trabajo de expansión dado por Pdv. Así también se asume que el gas es calóricamente perfecto (calor específico constante) de modo que du = cvdT. La primera ley también puede ser escrita:
Considérese la ecuación de estado del gas ideal con el bien conocido factor de compresibilidad Z: Pv = ZRT. Asumiendo que la constante del gas es también fija (por ejemplo, hay reacciones químicas). La ecuación de estado PV = ZRT puede ser diferenciada (derivada) para dar:
Basado en la relación específica de calor que surge de la definición de entalpía, el término ZR puede ser reemplazado por cp - cv. Con estas anotaciones la primera ley de la termodinámica se convierte en:
Donde γ es el índice de calor específico. Esta ecuación es importante para el entendimiento de la base de la ecuación de los procesos politrópicos. Ahora considérese la ecuación de proceso politrópico:
Tomando el logaritmo natural de ambos lados de la ecuación (entendiendo que el exponente n es una constante para un proceso politrópico) se tiene:
La cual puede ser diferenciada y reordenada de la siguiente forma:
Al comparar este resultado del resultado obtenido por la primera ley, se concluye que el exponenete politrópico es constante (y por lo tanto el proceso es politrópico) cuando el índice de transferencia de energía es constante para el proceso. De hecho el exponente politrópico puede ser expresado en términos del índice de transferencia de energía:
- .
Donde K es negativa para un gas ideal.
Esta derivación puede ser ampliada para incluir procesos politrópicos en sistemas abiertos incluyendo momentos en los que la energía cinética (ej. Número Mach) es significativo. También se puede ampliar para incluir procesos politropicos irreversibles.
Aplicabilidad
[editar]La ecuación del proceso politrópico se utiliza comúnmente para procesos reversibles o irreversibles de gases ideales o cercanos a los gases ideales que involucran transferencia de calor y/o interacciones de trabajo cuando el índice de transferencia de energía (δq/δw) es constante para el proceso. La ecuación podría no ser aplicables para procesos en un sistema abierto si la energía cinética (ej. Número Mach) es significativa. La ecuación también podría ser aplicable en algunos casos para procesos con líquidos e incluso sólidos.
Capacidad específica de calor
[editar]Es denotada por y es igual a
Relación con procesos ideales
[editar]Para valores específicos del índice politrópico, el proceso será idéntico al de otros procesos. Algunos ejemplos de los efectos de la variación de los valores del índice están dados en la tabla siguiente:
| Índice politrópico |
Relación | Efectos |
|---|---|---|
| — | Los exponentes negativos pueden también ser significativos en algunos casos especiales donde no hay dominación de las interacciones termales, como lo pueden ser algunos procesos de ciertos plasmas en astrofísica.[3] | |
(constante) |
Equivalente a un proceso isobárico (presión constante) | |
(constante) |
Equivalente a un proceso isotérmico (temperatura constante) | |
| — | Proceso cuasi-adiabático tal como en un motor de combustión interna durante la expansión o en la refrigeración por compresión de vapor durante la etapa de compresión. Así también como en un proceso de “compresión politrópica” como lo sería un gas a través de un compresor centrífugo donde la pérdida de calor del compresor (dentro del sistema) es mayor que el calor añadido al gas dentro de la compresión. | |
| — | es el exponente isentrópico produciendo un proceso isentrópico (adiabático y reversible). Esto también es ampliamente referido como el índice adiabático, produciendo un proceso adiabático (sin transferencia de calor). Sin embargo, el término adiabático no describe adecuadamente este proceso, debido a que éste solamente implica que no hay transferencia de calor.[4] Solo un proceso adiabático reversible es un proceso isentrópico. | |
| — | El índice politrópico normal es más grande que la razón específica de calor (gamma) dentro de un proceso de "compresión politrópica" como lo es un gas a través de un compresor centrífugo. Las ineficiencias de la compresión centrífuga y el calor añadido al gas sobrepasan a la pérdida de calor dentro del sistema. | |
| — | Equivalente a un proceso isocórico (volumen constante) |
Cuando el índice n está dentro de dos de los anteriores valores (0, 1, γ, o ∞) significa que la curva del proceso politrópico será una función restringida por las curvas de los dos índices correspondientes.
Nótese que , a partir de .
Notación
[editar]En el caso de un gas ideal isentrópico, es la tasa de calor específica, conocida como índice adiabátco o como exponente adiabático.
Un gas ideal isotermal es también un gas politrópico. Aquí, el índice politropico es igual a uno y difiere del índice adiabático .
Para poder diferenciar entre las dos gammas, la gamma politrópica es a veces escrita con mayúscula .
Para mayor confusión, algunos autores utilizan como el índice politrópico en vez de . Nótese que:
Otras
[editar]Una solución a la ecuación Lane-Emden usando un fluido politrópico es conocida como polítropo.
Referencias
[editar]- ↑ S.Gil, E. Rodriguez, "Procesos termodinámicos" en: Física creativa
- ↑ Christians, Joseph, "Approach for Teaching Polytropic Processes Based on the Energy Transfer Ratio, International Journal of Mechanical Engineering Education, Volumen 40, Número 1 (Enero2012), Manchester University Press
- ↑ G. P. Horedt Polytropes: Applications In Astrophysics And Related Fields, Springer, 10/08/2004, pp.24.
- ↑ Gas Processors Supliers Association Engineering Data Book,sección 13.































