Aldo-ceto reductasa
La familia aldo/ceto reductasa es una familia de enzimas que incluye una serie de oxidorreductasas monoméricas relacionadas NADPH-dependientes, tal como la aldehído reductasa, aldosa reductasa, prostaglandina-F sintasa, xilosa reductasa, rho cristalina, y muchas otros.[1]
Estructura
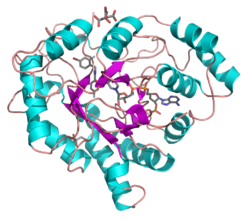
[editar]Todos poseen una estructura similar, con un característico pliegue beta-alfa-beta de las proteínas de unión de nucleótidos.[2] El pliegue comprende un beta-8/alfa-8-barril paralelo, que contiene un nuevo adorno ligante de NADP. El sitio de unión se encuentra en una gran bolsa profunda y elíptica en la punta terminal C de la beta-lámina, el sustrato estando unido en una conformación extendida. La naturaleza hidrofóbica de la bolsa favorece sustratos aromáticos y apolares por sobre los altamente polares.[3]
La unión de la coenzima NADPH causa un cambio conformacional masivo, reorientando un lazo, bloqueando la coenzima en su lugar. Esta unión es más similar a las oxidorreductasas que se unen a las FAD que a las que se unen a las NAD(P).[4]
Ejemplos
[editar]Algunas proteínas de esta familia contienen una cadena canal de potasio dominio regulador beta (potassium channel beta chain regulatory domain); estos son reportados de tener actividad oxidorreductasa.[5]
Referencias
[editar]- ↑ Bohren KM, Bullock B, Wermuth B, Gabbay KH (junio de 1989). «The aldo-keto reductase superfamily. cDNAs and deduced amino acid sequences of human aldehyde and aldose reductases». J. Biol. Chem. 264 (16): 9547-51. PMID 2498333.
- ↑ Schade SZ, Early SL, Williams TR, Kézdy FJ, Heinrikson RL, Grimshaw CE, Doughty CC (marzo de 1990). «Sequence analysis of bovine lens aldose reductase». J. Biol. Chem. 265 (7): 3628-35. PMID 2105951.
- ↑ Wilson DK, Bohren KM, Gabbay KH, Quiocho FA (julio de 1992). «An unlikely sugar substrate site in the 1.65 A structure of the human aldose reductase holoenzyme implicated in diabetic complications». Science 257 (5066): 81-4. PMID 1621098. doi:10.1126/science.1621098.
- ↑ Borhani DW, Harter TM, Petrash JM (diciembre de 1992). «The crystal structure of the aldose reductase.NADPH binary complex». J. Biol. Chem. 267 (34): 24841-7. PMID 1447221.
- ↑ Gulbis JM, Zhou M, Mann S, MacKinnon R (julio de 2000). «Structure of the cytoplasmic beta subunit-T1 assembly of voltage-dependent K+ channels». Science 289 (5476): 123-7. PMID 10884227. doi:10.1126/science.289.5476.123.