Cadena pesada

En inmunología se denomina cadena pesada a una subunidad polipeptídica grande de un complejo de proteínas como proteínas motoras (ej. miosina, kinesina, o dineína) o de un anticuerpo (o inmunoglobulina). Un anticuerpo típico se compone de dos cadenas pesadas de inmunoglobulina (Ig) y dos cadenas ligeras. Existen distintos tipos de cadenas pesadas que definen la clase o isotipo de un anticuerpo. Estos tipos de cadena pesada varían entre los diferentes animales. Todas las cadenas pesadas contienen una serie de dominios inmunoglobulina, normalmente con un dominio variable (IgV) que es importante para unirse al antígeno y varios dominios constantes (IgC).
En mamíferos
[editar]Clases
[editar]Hay cinco tipos de cadenas pesadas de inmunoglobulina en mamíferos: γ, δ, α, μ y ε.[1] Estas definen las llamadas clases de las inmunoglobulinas.
- Las cadenas pesadas α e γ poseen aproximadamente 450 aminoácidos.
- Las cadenas pesadas μ y ε tienen unos 550 aminoácidos.[1]
Regiones
[editar]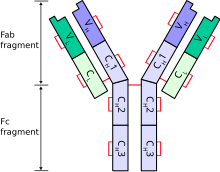
cada cadena pesada tiene dos regiones:
- una región constante (que es la misma para todas las inmunoglobulinas de la misma clase, pero difiere entre las diferentes clases de inmunoglobulina).
- Las cadenas pesadas γ, α y δ tienen una región constante compuesta por tres dominios estructurales de inmunoglobulina en tándem, aunque también poseen una "región bisagra" que le añade flexibilidad.[2]
- Las cadenas pesadas μ y ε tienen una región constante distinta compuesta por cuatro dominios de inmunoglobulina.[1]
- Una región variable que es diferente entre los distintos linfocitos B, pero que es la misma para todas las inmunoglobulinas producidas por el mismo linfocito B o su línea clonal. El dominio variable de una cadena pesada está compuesta por un único dominio inmunoglobulina. Estos dominios tienen unos 110 aminoácidos de longitud.
En peces
[editar]Los peces mandibulados son, aparentemente, los animales más primitivos capaces de generar anticuerpos como los descritos en el apartado de mamíferos.[3] No obstante, los peces no poseen el mismo tipo de repertorio de anticuerpos que los mamíferos.[4] Hasta la fecha se han identificado tres cadenas pesadas de inmunoglobulina diferentes en peces óseos.
- La primera identificada fue la cadena pesada μ que está presente en todos los peces mandibulados. Se piensa que es la cadena pesada de la que surgió la inmunoglobulina primordial. El anticuerpo resultante, IgM, se secreta como tetrámeno en teleósteos en lugar del típico pentámero que se encuentra en mamíferos y condrictios.
- La cadena pesada (δ) de la IgD se identificó al principio en el pez gato americano y en el salmón atlántico, y actualmente está bien documentado en muchas especies de teleósteos.[5]
- La tercera cadena pesada de inmunoglobulina en teleósteos fue identificada en 2005 y no se parece a ninguna de las identificadas en mamíferos hasta el momento. Esta cadena pesada, identificada tanto en la trucha arcoíris(τ) como en el pez cebra (ζ) podría potencialmente formar un isotipo distinto de anticuerpo que podría haber precedido a la IgM en la evolución.[6][7]
Al igual que en los peces óseos se han observado tres isotipos diferentes con sus cadenas pesadas en condrictios. Con la excepción de la IgM, éstos parecen ser únicos de este grupo y se designan como IgM, IgW (también denominadas IgX o IgNARC) e IgNAR.[8]
Referencias
[editar]- ↑ a b c Janeway CA, Jr. et al (2001). Immunobiology. (5th ed. edición). Garland Publishing. (electronic full text via NCBI Bookshelf) ISBN 0-8153-3642-X.
- ↑ Woof J, Burton D (2004). «Human antibody-Fc receptor interactions illuminated by crystal structures». Nat Rev Immunol 4 (2): 89-99. PMID 15040582. doi:10.1038/nri1266.
- ↑ Fish heavy chain and light chain genes
- ↑ Eva Bengtén, L. William Clem, Norman W. Miller, Gregory W. Warr and Melanie Wilson. Channel catfish immunoglobulins: Repertoire and expression. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 77-92.
- ↑ Stein Tore Solem and Jørgen Stenvik. Antibody repertoire development in teleosts--a review with emphasis on salmonids and Gadus morhua L. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 57-76.
- ↑ J.D. Hansen, E.D. Landis and R.B. Phillips. Discovery of a unique Ig heavy-chain isotype (IgT) in rainbow trout: Implications for a distinctive B cell developmental pathway in teleost fish. Proceedings of the National Academy of Sciences U S A. Volume 102, Issue 19, 2005, pages 6919-24.
- ↑ N. Danilova, J. Bussmann, K. Jekosch, L.A Steiner. The immunoglobulin heavy-chain locus in zebrafish: identification and expression of a previously unknown isotype, immunoglobulin Z. Nature Immunology, Volume 6, Issue 3, 2005, pages 295-302.
- ↑ H. Dooley and M.F. Flajnik. Antibody repertoire development in cartilaginous fish. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 43-56.
