Cinarizina
| Cinarizina | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
| (E)-1-(Diphenylmethyl)-4-(3-phenylprop-2-enyl)piperazine | ||
| Identificadores | ||
| Número CAS | 298-57-7 | |
| Código ATC | N07CA02 | |
| PubChem | 1547484 | |
| DrugBank | DB00568 | |
| ChemSpider | 1264793 | |
| UNII | 3DI2E1X18L | |
| KEGG | D01295 | |
| ChEBI | 31403 | |
| ChEMBL | 43064 | |
| Datos químicos | ||
| Fórmula | C26H28N2 | |
|
c1c(cccc1)C(c2ccccc2)N3CCN(CC3)C\C=C\c4ccccc4
| ||
|
InChI=1S/C26H28N2/c1-4-11-23(12-5-1)13-10-18-27-19-21-28(22-20-27)26(24-14-6-2-7-15-24)25-16-8-3-9-17-25/h1-17,26H,18-22H2/b13-10+
Key: DERZBLKQOCDDDZ-JLHYYAGUSA-N | ||
| Farmacocinética | ||
| Vida media | 3–4 h | |
| Datos clínicos | ||
| Estado legal | P (UK) | |
| Vías de adm. | Oral | |
La cinarizina es un fármaco derivado de la piperazina, caracterizado como antihistamínico y bloqueador de los canales de calcio. También se sabe que promueve el flujo de sangre cerebral, por lo que se usa para tratar accidentes cerebrovasculares, síntomas cerebrales postraumáticos y arteriosclerosis cerebral.[1][2] Sin embargo, se prescribe más comúnmente para náusea y vómitos debidos a cinetosis u otras causas como quimioterapia, vértigo o enfermedad de Ménière.[3][4][5][6] La cinarizina la sintetizó en 1955 Janssen Pharmaceutica. El nombre genérico se deriva del sustituyente cinamilo sobre uno de los átomos de nitrógeno, combinado con el sufijo genérico "-rizina" para "antihistamínicos/vasodilatador cerebral (o periférico)".[7] No está disponible en Estados Unidos ni en Canadá. Lo fabrica y comercializa Rephco Pharmaceuticals Ltd en Bangladés con el nombre comercial Suzaraon. También ha sido uno de los fármacos más utilizados por la Marina Real Británica para los casos de mareo.[8]
Usos
[editar]La cinarizina se utiliza principalmente para tratar náuseas y vómitos asociados con cinetosis, vértigo, enfermedad de Ménière o síndrome de Cogan.[3][5][6][9] De hecho, es uno de los pocos fármacos que ha mostrado un efecto beneficioso en el tratamiento crónico del vértigo y el tinnitus, asociados con la enfermedad de Ménière.[10] Aun así, debido a un aumento en los niveles de somnolencia, su uso se controla en el caso de pilotos y su tripulación, quienes tienen que estar en estado de alerta.[3] En un estudio clínico (n=181), el tratamiento con cinarizina redujo la ocurrencia de vértigo moderado en un 65.8% y vértigo extremo en 89.8%.[5]
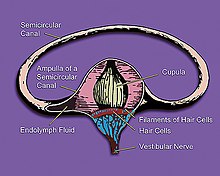
Actúa interfiriendo la transmisión de la señal entre el aparato vestibular del oído interno y el centro del vómito del hipotálamo al limitar la actividad de las células ciliadas vestibulares que envían señales acerca del movimiento.[11] La disparidad del procesamiento de la señal entre los receptores de movimiento del oído interno y el sentido visual se suprime, de modo que la señal confusa del cerebro sobre si la persona se está moviendo o no se ve reducida. Los vómitos en cinetosis podrían ser un mecanismo compensatorio fisiológico del cerebro para evitar que la persona se siga moviendo, para así ajustarse a la percepción de las señales, pero la verdadera razón evolutiva de este mal sigue sin entenderse plenamente.[12]
Cuando se prescribe para problemas de equilibrio y vértigo, la cinarizina se toma dos o tres veces al día dependiendo de la cantidad de cada dosis, y cuando se utiliza para tratar la cinetosis, el comprimido se toma al menos dos horas antes de viajar y nuevamente cada cuatro horas durante el viaje.[13] Sin embargo, un estudio reciente del 2012 que comparó los efectos de la cinarizina con la escopolamina transdérmica para el tratamiento del mareo reportó que la escopolamina era significativamente más eficaz y tenía menos efectos adversos que la cinarizina.[14] Esto llevó a la conclusión de que la escopolamina transdérmica puede ser una mejor opción para el tratamiento de cinetosis en la tripulación naval y otras personas que viajen en el mar.
Más allá del tratamiento antivértigo, la cinarizina también podría verse como un fármaco nootrópico, debido a su capacidad vasorelajadora (debido al bloqueo de los canales de calcio), lo cual sucede principalmente en el cerebro, y el hecho de que también se usa como sedante laberíntico.[15][16] La cinarizina inhibe el flujo de calcio a los glóbulos rojos, lo que aumenta la elasticidad de la célula, aumentando así su flexibilidad y haciendo la sangre menos viscosa.[9] Esto permite a la sangre viajar más eficientemente a través de los vasos sanguíneos estrechados para llevar oxígeno a tejidos dañados.[9] También se combina eficazmente con otros nootrópicos, principalmente piracetam; en tal combinación cada fármaco potencia el otro en aumentar el suministro de oxígeno del cerebro.[17] Un estudio en animales que comparó la efectividad de la cinarizina y la flunarizina (un derivado de la cinarizina que es 2,5-15 veces más potente para el tratamiento de la isquemia cerebral global transitoria) encontró que la cinarizina ayudó a mejorar las anormalidades funcionales de la isquemia, pero no ayudó con el daño neuronal.[18][19] La flunarizina, por otro lado, ofreció más protección neuronal, pero fue menos eficaz para el tratamiento de los cambios de comportamiento posteriores.[19]
Además, la cinarizina puede utilizarse en el buceo, sin riesgo incrementado de toxicidad por oxígeno en el sistema nervioso central, que puede provocar convulsiones, y resulta entonces de alto riesgo en buceo con oxígeno de circuito cerrado.[20] Esto también es importante para buzos que podrían someterse a terapia hiperbárica para la descompresión, que utiliza alta presión de oxígeno, por lo que también podría verse afectada por cualquier riesgo de toxicidad por oxígeno del sistema nervioso inducida por cinarizina. No obstante, la cinarizina no aumenta el riesgo de toxicidad; de hecho, la evidencia incluso parece sugerir que la cinarizina puede contribuir al retrasar la toxicidad por oxígeno en el sistema nervioso central.[20] Hay también evidencia de que la cinarizina puede usarse como eficaz antiasmático cuando se toma con regularidad.[21]
Se ha descubierto que la cinarizina también es útil como tratamiento de segunda línea para la vasculitis urticarial idiopática.[22]
Efectos adversos
[editar]Los efectos adversos que se experimentan con la cinarizina pueden ser desde suaves a bastante severos. Los posibles efectos adversos incluyen somnolencia, sudoración, sequedad bucal, dolor de cabeza, problemas en la piel, letargo, irritación gastrointestinal, reacciones de hipersensibilidad, así como rigidez muscular, problemas de movimiento y temblor.[13] Debido a que la cinarizina puede causar somnolencia y visión borrosa, es importante que los usuarios se aseguren de que no presentan reacciones poco habituales o riesgosas antes de conducir, operar maquinaria o antes de realizar cualquier otro trabajo que pueda ser peligroso si no se está plenamente alerta o capaz de prestar la debida atención.[3]
Se sabe también que la cinarizina puede causar parkinsonismo agudo y crónico,[18] debido a su afinidad por los receptores D2 de dopamina, lo que va fuertemente en sentido contrario a su utilidad para mejorar la salud neurológica. Los efectos antagonistas de los receptores D2 de la cinarizina en el cuerpo estriado provocan síntomas de depresión, temblor, rigidez muscular, discinesia tardía y acatisia, los cuales se caracterizan como una enfermedad de Parkinson inducida por fármacos y son la segunda causa principal de Parkinson.[18] La evidencia sugiere que uno de los metabolitos de la cinarizina, el C-2, puede contribuir al desarrollo de Parkinson inducido por fármacos.[23] También debe señalarse que aproximadamente 17 de cada 100 nuevos casos de Parkinson se relacionan con la administración de cinarizina o de flunarizina, lo que hace que la cinarizina y el Parkinson inducido por fármacos se consideren un asunto serio.[1] Aquellas personas especialmente en riesgo son pacientes ancianos, en particular mujeres, y pacientes que han tomado el fármaco para una gran cantidad de tiempo.[24] Hay también evidencia que sugiere que en pacientes con una historia familiar de Parkinson, o una predisposición genética a la enfermedad, es más probable que se desarrolle la enfermedad inducida a raíz del tratamiento con cinarizina.[25]
Además del antagonismo de los receptores D2, se ha mostrado que el tratamiento con cinarizina también provoca reducción en la concentración de dopamina y serotonina presinápticas, así como alteraciones en el transporte vesicular de dopamina.[1] Terland et al. han mostrado que el tratamiento crónico con cinarizina logra concentraciones de fármaco suficientemente altas como para interferir con el gradiente electroquímico de protones necesario para almacenar dopamina en las vesículas.[1] La cinarizina, de pKa = 7,4, actúa como un protonóforo, lo que impide la producción del gradiente electroquímico dependiente de ATP-Mg, crucial para el transporte y almacenamiento de dopamina en vesículas, y de esa manera baja los niveles de dopamina en las neuronas de los ganglios basales y provoca los síntomas de Parkinson.[1]
Además, se han reportado varios casos de sobredosis de cinarizina en pacientes pediátricos y adultos, con efectos que incluyen una variedad de síntomas como somnolencia, coma, vómitos, hipotonía, estupor y convulsiones.[26] Las complicaciones cognitivas probablemente son resultado del efecto antihistamínico de la cinarizina, mientras que los efectos motores son producto de las propiedades antidopaminérgicas. En casos de sobredosis, el paciente tendría que ser llevado a un hospital para ser observado por las posibles complicaciones neurológicas.
Farmacocinética
[editar]La vía de administración más común de la cinarizina es la oral, en comprimidos, y la frecuencia y cantidad de dosificación varían dependiendo de la causa a tratar. Una vez tomado, el fármaco se absorbe rápidamente y logra un pico de concentración en plasma en 1–3 horas.[27][28][29] La concentración máxima (Cmax) en sangre es de 275 +/- 36 ng/mL, donde tmax, el tiempo necesario para que el fármaco alcance Cmax, es de 3,0 +/-0,5 horas.[28] El área bajo la curva (AUC∞), que puede usarse para estimar la biodisponibilidad, es de 4437 +/- 948 (ng·h/mL).[28] El tiempo de vida media de eliminación varía de 3,4–60 horas, dependiendo de la edad.[29] Sin embargo, se encontró que el promedio de vida media en voluntarios jóvenes con una administración de 75 mg de cinarizina es de 23,6 +/- 3,2 horas.[28]
En un estudio donde se administró una dosis de 75 mg de cinarizina, dos veces al día por doce días, a voluntarios sanos, se observó que la cinarizina se acumula en el cuerpo con un factor de acumulación de estado estacionario de 2,79 +/- 0,23.[28] Aun así, el AUC T para esta cantidad de tiempo (T=12 días) no fue significativamente diferente del AUC∞, el que se estimó a partir de la administración de una sola dosis. Tiene un carácter débilmente básico y también es un compuesto lipofílico con una baja solubilidad en agua, por lo que la cinarizina es capaz de cruzar la barrera hematoencefálica por difusión simple.[30][31] Debido a esta propiedad, es capaz de ejercer sus efectos en el flujo de sangre cerebral. [32]
La biodisponibilidad en una administración oral de cinarizina es baja y variable, debido a una alta incidencia de degradación.[31] Sin embargo, se ha encontrado que la administración intravenosa en una emulsión lipídica mejora la farmacocinética.[33] Esta administración tuvo una AUC más alta y una depuración más baja que en forma de solución, lo cual significó un aumento de la biodisponibilidad de cinarizina, mejorando el efecto terapéutico.[33] La farmacocinética en plasma de la cinarizina administrada intravenosamente sigue un modelo de tres compartimientos, primero con una fase de distribución rápida, seguido por una fase de distribución más lenta, y acaba con una eliminación muy lenta.[33] El Vdee (volumen de distribución aparente de estado estacionario) para la administración de la emulsión de lípido es 2 veces más bajo (6,871 +/- 1,432 L/kg) que la solución de cinarizina (14,018 +/- 5,598 L/kg), y se encontró que en la condición de emulsión de lípido se distribuyó significativamente menos cinarizina al pulmón y al cerebro.[33] Esto es importante porque reduce la probabilidad de efectos tóxicos en el sistema nervioso central.
Farmacodinamia
[editar]La cinarizina se clasifica como antagonista selectivo de los canales iónicos de calcio dependientes de voltaje tipo T, porque bloquea los canales y los mantiene inertes.[9][24] Tiene un valor de Ki (constante inhibitoria) de 22 nM.[34] También se sabe que tiene efectos antihistamínicos, antiserotoninérgicos y antidopaminérgicos, al unirse a los receptores H1 de histamina y D2 de dopamina.[24][23] La CI50 (concentración inhibitoria máxima media) de cinarizina para inhibir la contracción del músculo liso es de 60 mM y se ha mostrado que este fármaco se une preferentemente a sus canales de calcio objetivo cuando están en una conformación abierta.[35][36] Respecto al tratamiento de la náusea y la cinetosis, se creía que la cinarizina ejerce sus efectos al inhibir el flujo de calcio en los canales dependientes de voltaje en las células ciliadas vestibulares tipo II dentro del oído interno.[6] Sin embargo, la evidencia más reciente apoya la idea de que, a niveles farmacológicamente relevantes (0.3µM–0.5µM), la cinarizina no disminuye el vértigo vestibular por bloqueo de los canales de calcio, sino al inhibir el flujo de potasio (K+) que se activa por la presión hidrostática aumentada en las células ciliadas.[11] Si bien es cierto que la cinarizina suprime el flujo de calcio en las células ciliadas vestibulares, esto ocurre en concentraciones más altas del fármaco (3 µM).[11] Esta inhibición provoca una disminución del vértigo y de las náuseas inducidas por la cinetosis, al reducir la hiperreactividad de las células ciliadas, las que envían información al cerebro acerca del equilibrio y el movimiento.
| Acción de la cinarizina | Blanco de acción |
|---|---|
| Antagonista de canal iónico de calcio | Canales de calcio tipo T |
| Antihistamínico | Repectores H1 |
| Antiserotinérgico | Receptores 5-HT2 [37] |
| Antidopaminérgico | Receptores D2 |
Eliminación
[editar]Después de la administración, la cinarizina se metaboliza por completo, y un tercio de los metabolitos se eliminan en la orina y dos tercios en los residuos sólidos.[9]
Véase también
[editar]Referencias
[editar]- ↑ a b c d e Terland, O.; Flatmark, T. (1999). «Drug-induced parkinsonism: Cinnarizine and flunarizine are potent uncouplers of the vacuolar H+-ATPase in catecholamine storage vesicles». Neuropharmacology 38 (6): 879-882. PMID 10465691. doi:10.1016/s0028-3908(98)00233-0.
- ↑ Singh, B. N. (1986). «The mechanism of action of calcium antagonists relative to their clinical applications». British Journal of Clinical Pharmacology. 21 Suppl 2 (Suppl 2): 109S-121S. PMC 1400740. PMID 3530295.
- ↑ a b c d Nicholson, A. N.; Stone, B. M.; Turner, C.; Mills, S. L. (2002). «Central effects of cinnarizine: Restricted use in aircrew». Aviation, space, and environmental medicine 73 (6): 570-574. PMID 12056673.
- ↑ Wilder-Smith, C. H.; Schimke, J.; Osterwalder, B.; Senn, H. J. (1991). «Cinnarizine for prevention of nausea and vomiting during platin chemotherapy». Acta oncologica (Stockholm, Sweden) 30 (6): 731-734. PMID 1958394. doi:10.3109/02841869109092448.
- ↑ a b c Pianese, C. P.; Hidalgo, L. O.; Gonz??Lez, R. H.; Madrid, C. E.; Ponce, J. E.; Ram??Rez, A. M.; Mor??n, L. M.; Arenas, J. E.; Rubio, A. T.; Uribe, J. O.; Abiuso, J. ?; Hanuch, E.; Alegr??a, J.; Volpi, C.; Flaskamp, R.; Sanju??n, A. P. ?A.; g??Mez, J. M. G. ?A.; Hern??Ndez, J.; Pedraza, A.; Quijano, D.; Mart??Nez, C.; Casta??Eda, J. R. ?N.; Guerra, O. J. C. ?O.; f, G. V. (2002). «New approaches to the management of peripheral vertigo: Efficacy and safety of two calcium antagonists in a 12-week, multinational, double-blind study». Otology & neurotology : official publication of the American Otological Society, American Neurotology Society \and] European Academy of Otology and Neurotology 23 (3): 357-363. PMID 11981396. doi:10.1097/00129492-200205000-00023.
- ↑ a b c Arab, S. F.; Düwel, P.; Jüngling, E.; Westhofen, M.; Lückhoff, A. (2004). «Inhibition of voltage-gated calcium currents in type II vestibular hair cells by cinnarizine». Naunyn-Schmiedeberg's Archives of Pharmacology 369 (6): 570-575. PMID 15138660. doi:10.1007/s00210-004-0936-3.
- ↑ «The use of stems in the selection of International Nonproprietary Names (INN) for pharmaceutical substances 2011». WHO. Consultado el 12 de marzo de 2015.
- ↑ Lucertini, M.; Mirante, N.; Casagrande, M.; Trivelloni, P.; Lugli, V. (2007). «The effect of cinnarizine and cocculus indicus on simulator sickness». Physiology & Behavior 91 (1): 180-190. PMID 17434541. doi:10.1016/j.physbeh.2007.02.008.
- ↑ a b c d e Deka, C.V.R. (2006). «Role of Cinnarizine in Peripheral Vertigo». Vertigo Viewpoint 4 (1): 2-4.
- ↑ Ganança, M. M.; Caovilla, H. H.; Munhoz, M. S.; Ganança, C. F.; Da Silva, M. L.; Serafini, F.; Ganança, F. F. (2007). «Optimizing the pharmacological component of integrated balance therapy». Brazilian journal of otorhinolaryngology 73 (1): 12-18. PMID 17505593. doi:10.1016/s1808-8694(15)31116-2.
- ↑ a b c Haasler, T.; Homann, G.; Duong Dinh, T. A.; Jüngling, E.; Westhofen, M.; Lückhoff, A. (2009). «Pharmacological modulation of transmitter release by inhibition of pressure-dependent potassium currents in vestibular hair cells». Naunyn-Schmiedeberg's Archives of Pharmacology 380 (6): 531-538. PMID 19830405. doi:10.1007/s00210-009-0463-3.
- ↑ Yates, B. J.; Miller, A. D.; Lucot, J. B. (1998). «Physiological basis and pharmacology of motion sickness: An update». Brain Research Bulletin 47 (5): 395-406. PMID 10052567. doi:10.1016/s0361-9230(98)00092-6.
- ↑ a b «Stugeron 15». NHS. Archivado desde el original el 7 de mayo de 2012. Consultado el 21 de octubre de 2012.
- ↑ Gil, A.; Nachum, Z.; Tal, D.; Shupak, A. (2012). «A Comparison of Cinnarizine and Transdermal Scopolamine for the Prevention of Seasickness in Naval Crew». Clinical Neuropharmacology 35 (1): 37-39. PMID 22139622. doi:10.1097/WNF.0b013e31823dc125.
- ↑ Saletu, B.; Grünberger, J. (1980). «Antihypoxidotic and nootropic drugs: Proof of their encephalotropic and pharmacodynamic properties by quantitative EEG investigations». Progress in neuro-psychopharmacology 4 (4–5): 469-489. PMID 7012879. doi:10.1016/0364-7722(80)90017-x.
- ↑ Towse, G. (1980). «Cinnarizine--a labyrinthine sedative». The Journal of laryngology and otology 94 (9): 1009-1015. PMID 7000939. doi:10.1017/s0022215100089787.
- ↑ RomPharm.
- ↑ a b c Teive, H. L. A. G.; Troiano, A. R.; Germiniani, F. M. B.; Werneck, L. C. (2004). «Flunarizine and cinnarizine-induced parkinsonism: A historical and clinical analysis». Parkinsonism & Related Disorders 10 (4): 243-245. PMID 15120099. doi:10.1016/j.parkreldis.2003.12.004.
- ↑ a b Poignet, H.; Beaughard, M.; Lecoin, G.; Massingham, R. (1989). «Functional, Behavioral, and Histological Changes Induced by Transient Global Cerebral Ischemia in Rats: Effects of Cinnarizine and Flunarizine». Journal of Cerebral Blood Flow & Metabolism 9 (5): 646-654. PMID 2777934. doi:10.1038/jcbfm.1989.92.
- ↑ a b Arieli, R.; Shupak, A.; Shachal, B.; Shenedrey, A.; Ertracht, O.; Rashkovan, G. (1999). «Effect of the anti-motion-sickness medication cinnarizine on central nervous system oxygen toxicity». Undersea & hyperbaric medicine : journal of the Undersea and Hyperbaric Medical Society, Inc 26 (2): 105-109. PMID 10372430.
- ↑ Emanuel, M. B.; Chamberlain, J. A.; Whiting, S.; Rigden, B. G.; Craven, A. H. (1979). «Cinnarizine in the treatment of chronic asthma». British Journal of Clinical Pharmacology 7 (2): 189-195. PMC 1429430. PMID 367414. doi:10.1111/j.1365-2125.1979.tb00920.x.
- ↑ Tosoni, C.; Lodi-Rizzini, F.; Cinquini, M.; Pasolini, G.; Venturini, M.; Sinico, R. A.; Calzavara-Pinton, P. (2009). «A reassessment of diagnostic criteria and treatment of idiopathic urticarial vasculitis: A retrospective study of 47 patients». Clinical and Experimental Dermatology 34 (2): 166-170. PMID 18681869. doi:10.1111/j.1365-2230.2008.02891.x.
- ↑ a b Kariya, S.; Isozaki, S.; Masubuchi, Y.; Suzuki, T.; Narimatsu, S. (1995). «Possible pharmacokinetic and pharmacodynamic factors affecting parkinsonism inducement by cinnarizine and flunarizine». Biochemical Pharmacology 50 (10): 1645-1650. PMID 7503767. doi:10.1016/0006-2952(95)02057-8.
- ↑ a b c Fabiani, G.; Pastro, P. C.; Froehner, C. (2004). «Parkinsonism and other movement disorders in outpatients in chronic use of cinnarizine and flunarizine». Arquivos de neuro-psiquiatria 62 (3B): 784-788. PMID 15476069. doi:10.1590/S0004-282X2004000500008.
- ↑ Serrano, A.; Menendez, J.; Casarejos, M.; Solano, R.; Gallego, E.; Sanchez, M.; Mena, M.; Garciadeyebenes, J. (2005). «Effects of cinnarizine, a calcium antagonist that produces human parkinsonism, in parkin knock out mice». Neuropharmacology 49 (2): 208-219. PMID 15993444. doi:10.1016/j.neuropharm.2005.03.003.
- ↑ Turner, D.; Lurie, Y.; Finkelstein, Y.; Schmid, T.; Gopher, A.; Kleid, D.; Bentur, Y. (2006). «Pediatric Cinnarizine Overdose and Toxicokinetics». Pediatrics 117 (5): e1067-e1069. PMID 16636115. doi:10.1542/peds.2005-2059.
- ↑ Spagnoli, A.; Tognoni, G. (1983). «'Cerebroactive' drugs. Clinical pharmacology and therapeutic role in cerebrovascular disorders». Drugs 26 (1): 44-69. PMID 6349963. doi:10.2165/00003495-198326010-00003.
- ↑ a b c d e Castañeda-Hernández, G.; Vargas-Alvarado, Y.; Aguirre, F.; Flores-Murrieta, F. J. (1993). «Pharmacokinetics of cinnarizine after single and multiple dosing in healthy volunteers». Arzneimittel-Forschung 43 (5): 539-542. PMID 8328998.
- ↑ a b Nowacka-Krukowska, H.; Rakowska, M.; Neubart, K.; Kobylińska, M. (2007). «High-performance liquid chromatographic assay for cinnarizine in human plasma». Acta poloniae pharmaceutica 64 (5): 407-411. PMID 18540159.
- ↑ Kornhuber, J.; Henkel, A. W.; Groemer, T. W.; Städtler, S.; Welzel, O.; Tripal, P.; Rotter, A.; Bleich, S. et al. (2010). «Lipophilic cationic drugs increase the permeability of lysosomal membranes in a cell culture system». Journal of Cellular Physiology 224 (1): 152-164. PMID 20301195. doi:10.1002/jcp.22112.
- ↑ a b Kalava, B.S.; Muzeyyen, Demirel; Yasemin, Yazan (2005). «Physicochemical characterization and dissolution properties of cinnarizine solid dispersions». J. Pharm. Sci (en turkish) 2 (2): 51-62.
- ↑ Emanuel, M. B. (1979). «Specific calcium antagonists in the treatment of peripheral vascular disease». Angiology 30 (7): 454-469. PMID 464337. doi:10.1177/000331977903000704.
- ↑ a b c d Shi, S.; Chen, H.; Lin, X.; Tang, X. (2010). «Pharmacokinetics, tissue distribution and safety of cinnarizine delivered in lipid emulsion». International Journal of Pharmaceutics 383 (1–2): 264-270. PMID 19770029. doi:10.1016/j.ijpharm.2009.09.025.
- ↑ Klein, M.; Musacchio, J. M. (1989). «High affinity dextromethorphan binding sites in guinea pig brain. Effect of sigma ligands and other agents». The Journal of Pharmacology and Experimental Therapeutics 251 (1): 207-215. PMID 2477524.
- ↑ Silver, P. J.; Dachiw, J.; Ambrose, J. M.; Pinto, P. B. (1985). «Effects of the calcium antagonists perhexiline and cinnarizine on vascular and cardiac contractile protein function». The Journal of Pharmacology and Experimental Therapeutics 234 (3): 629-635. PMID 3162016.
- ↑ López, M. G.; Moro, M. A.; Castillo, C. F.; Artalejo, C. R.; García, A. G. (1989). «Variable, voltage-dependent, blocking effects of nitrendipine, verapamil, diltiazem, cinnarizine and cadmium on adrenomedullary secretion». British Journal of Pharmacology 96 (3): 725-731. PMC 1854390. PMID 2720300. doi:10.1111/j.1476-5381.1989.tb11874.x.
- ↑ Pukhal'Skaya, T. G.; Kolosova, O. A.; Men'Shikov, M. Y.; Vein, A. M. (2000). «Effects of calcium antagonists on serotonin-dependent aggregation and serotonin transport in platelets of patients with migraine». Bulletin of experimental biology and medicine 130 (7): 633-635. PMID 11140571.
