Degarelix
| Degarelix | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
| N-acetil-3-(2-naftil)-D-alanil-4-cloro-D-fenilalanil-3-(3-piridil)-D-alanil-L-seril-4-((S)-dihidroorotamido)-L-fenilalanil-4-ureido-D-fenilalanil-L-leucil-N6-isopropil-L-lisil-L-prolil-D-alaninamida | ||
| Identificadores | ||
| Número CAS | 214766-78-6 | |
| Código ATC | L02BX02 | |
| Datos químicos | ||
| Fórmula | C82H103N18ClO16 | |
| Peso mol. | 1632.286 g/mol | |
| Datos clínicos | ||
| Estado legal | Grupo IV (Medicamentos expedidos mediante receta médica, autorizados para su venta exclusivamente en farmacias.) (MEX) | |
El Degarelix (INN International Nonproprietary Name) o degarelix de etilo (USAN) es una terapia hormonal usada en el tratamiento de cáncer de próstata.
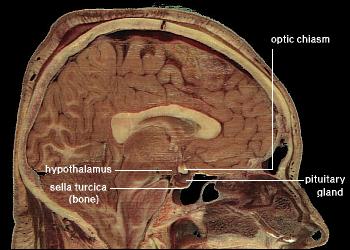
La hormona liberadora de gonadotropinas (GnRH), se libera en el hipotálamo y estimula, en la parte anterior de la hipófisis, la liberación de hormonas gonadotrópicas (FSH y LH), las cuales a su vez estimulan la producción de testosterona en los testículos. Esta, es una hormona masculina que promueve el crecimiento de los tumores de próstata. Al reducir los niveles de testosterona en sangre, a los mismos que se obtienen con la castración, se disminuye la acción de esta hormona sobre la próstata, lo cual a menudo es el objetivo del tratamiento en el manejo de los hombres con cáncer de próstata avanzado. El Degarelix tiene un inicio de acción inmediato porque se une a los receptores de GnRh y bloquea de su interacción. Esto induce una reducción rápida y profunda en la hormona luteinizante (LH), hormona estimulante del folículo (FSH) y, a su vez, la supresión de la testosterona.[1]
Aprobación
[editar]En 2008, la Agencia de Administración de Alimentos y Medicamentos (FDA) aprobó en los EE.UU la droga degarelix para el tratamiento de pacientes con cáncer de próstata avanzado.[2] Luego fue aprobado por la Agencia Europea de Medicamentos (EMEA), en 2009, para su uso en pacientes varones adultos con cáncer de próstata hormono-dependiente avanzado. Ferring Pharmaceuticals comercializa la droga bajo el nombre Firmagon, que durante su desarrollo era conocida como FE200486.
Mecanismo de acción
[editar]El degarelix es antagonista de la GnRH, al bloquear sus receptores en las células de la Hipófisis.
Forma parte de un nuevo tipo de medicamentos usados en la terapia hormonal del cáncer de próstata. Estos agentes son péptidos sintéticos derivados del neuropéptido natural GnRH.
La GnRH es una hormona liberada por las neuronas en el Hipotálamo. El antagonista degarelix compite con la GnRH natural por la unión a los receptores de las células de la Hipófisis.
La unión del degarelix al receptor genera un bloqueo en la liberación de las hormonas gonadotróficas que son la LH y la FSH desde la Hipófisis. La reducción de los niveles de la LH conduce a una supresión rápida y sostenida de liberación de testosterona por los testículos, lo cual, posteriormente, reduce el tamaño y el crecimiento del cáncer de próstata. Esto a su vez resulta en una reducción en los niveles de Antígeno prostático específico (PSA) en la sangre del paciente. Medir los niveles de PSA es una manera habitual de controlar cómo los pacientes con cáncer de próstata responden al tratamiento.
Los agonistas de la GnRH causan una estimulación inicial del eje hipotálamo-hipofisario-gonadal, llamado “efecto de llamarada”, que genera a un aumento en los niveles de testosterona, y bajo ciertas circunstancias, un aumento del tamaño del tumor; a diferencia de estos, los antagonistas de la GnRH no causan un aumento en los niveles de testosterona en sangre.[3] Este “efecto de llamarada”, en los pacientes con enfermedad avanzada, puede precipitar una serie de síntomas clínicos como dolor de huesos, obstrucción uretral y compresión de la médula espinal. Debido a esto la FDA emitió un comunicado en el cual señala que los agonistas de la GnRH deben de colocar esta advertencia en su etiqueta de prescripción. Para contrarrestar este efecto se usan, antes de que se inicie el tratamiento con los agonistas de la GnRh, medicamentos que bloquean la acción de la testosterona en la próstata (antiandrógenos). Esta terapia que no está indicada cuando se usa el degarelix, por su efecto de bloqueo directo sobre los receptores en la hipófisis. Los agonistas de la GnRH también inducen un aumento en los niveles de testosterona después de cada reinyección de la droga, un fenómeno que no ocurre con los antagonistas de la GnRH como el degarelix.
Los antagonistas de la GnRH tienen un inicio de acción inmediata que conduce a una supresión rápida y profunda de la testosterona y por lo tanto son especialmente valiosos en el tratamiento de pacientes con cáncer de próstata donde se necesita un control rápido de la enfermedad.
Efectividad clínica
[editar]En el estudio clínico Fase III, aleatorizado, de 12 meses (CS21) en pacientes con cáncer de próstata[4] se comparó la deprivación de andrógenos con dos dosis de degarelix vs leuprolide, que es un agonista de GnRH. Ambas dosis de degarelix eran, al menos, tan eficaz como el leuprolide en la supresión de la testosterona a niveles de castración (≤0.5 ng / ml), desde el día 28 hasta el final del estudio (día 364). Los niveles de testosterona se suprimieron significativamente más rápido con degarelix que con leuprolide, con degarelix se lograron niveles de castración uniformes desde el día 3; mientras que en los pacientes que recibieron leuprolide no se observó la disminución de la testosterona sino mucho más tarde. No hubo oleadas de testosterona con degarelix, en comparación con los aumentos repentinos en muchos de los pacientes que recibieron leuprolide. Degarelix resultó en una reducción más rápida en los niveles de PSA en comparación con leuprolide, lo que indica un control más rápido del cáncer de próstata. Resultados recientes también sugieren que la terapia con degarelix puede resultar en un control más prolongado de los pacientes con cáncer de próstata, en comparación con leuprolide.[5]
Efectos secundarios
[editar]Al igual que con todas las terapias hormonales, el degarelix se asocia con efectos secundarios hormonales tales como sofocos y aumento de peso.[4][6][7] Debido a su modo de administración (inyección subcutánea), el uso de degarelix está también asociado a reacciones en el lugar de inyección como dolor, eritema o hinchazón. Estas reacciones suelen ser leves o moderadas y ocurren predominantemente después de la primera dosis, con disminución en la frecuencia a partir de entonces.[4]
Receptores de FSH en otros tumores sólidos
[editar]Los receptores de FSH se expresan selectivamente en la superficie de la parte interna de los vasos sanguíneos, de una amplia gama de tumores.[8] La supresión de FSH o de sus receptores de FSH podría tener un papel importante en el tratamiento de esta patología; sin embargo, estos estudios se encuentran en las etapas iniciales. Se cree que los receptores de FSH son importantes en la angiogénesis tumoral mediante la señalización a través de dos vías, uno que usa el Factor de Crecimiento Endotelial Vascular (VEGF), y otra que activa los mecanismos de Gq/11 independientemente de VEGF.[8]
Referencias
[editar]- ↑ Princivalle M, Broqua P, White R, et al (March 2007). Rapid suppression of plasma testosterone levels and tumor growth in the dunning rat model treated with degarelix, a new gonadotropin-releasing hormone antagonist. J. Pharmacol. Exp. Ther. 320: 1113-8.
- ↑ PR Newswire.
- ↑ Van Poppel H, Nilsson S (June 2008).
- ↑ a b c Klotz L, Boccon-Gibod L, Shore ND, et al (December 2008).
- ↑ Schröder FH, Boccon-Gibod L, Tombal B, et al (March 2009) Degarelix versus leuprolide in patients with prostate cancer: effect in metastatic patients as assessed by serum alkaline phosphatase.
- ↑ Gittelman M, Pommerville PJ, Persson BE, et al (November 2008).
- ↑ Van Poppel H, Tombal B, de la Rosette JJ, et al (October 2008).
- ↑ a b Radu, A.; Pichon, C.; Camparo, P.; Antoine, M.; Allory, Y.; Couvelard, A.; Fromont, G. L.; Hai, M. T. V.; Ghinea, N. (2010). "Expression of Follicle-Stimulating Hormone Receptor in Tumor Blood Vessels". New England Journal of Medicine 363 (17): 1621–1630. doi:10.1056/NEJMoa1001283. PMID 20961245.
