Diferencia entre revisiones de «Benceno»
nombre incorrecto eliminado |
Deshecha la edición 27050474 de 189.178.61.61 (disc.) |
||
| Línea 1: | Línea 1: | ||
{{Ficha de compuesto químico |
{{Ficha de compuesto químico |
||
|IUPAC= |
|IUPAC= 1,3,5-Ciclohexatrieno |
||
|otros nombres=Benzol, Bencina |
|otros nombres=Benzol, Bencina |
||
|imagen=[[Archivo:Benzene_structure.png|250px|Benzene]] |
|imagen=[[Archivo:Benzene_structure.png|250px|Benzene]] |
||
Revisión del 22:11 11 jun 2009
| Benceno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,3,5-Ciclohexatrieno | ||
| General | ||
| Otros nombres | Benzol, Bencina | |
| Fórmula semidesarrollada | C6H6 | |
| Fórmula estructural |
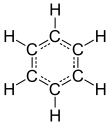 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | [71-43-2][1] | |
| Número RTECS | CY1400000 | |
| ChEBI | 16716 | |
| ChEMBL | CHEMBL277500 | |
| ChemSpider | 236 | |
| PubChem | 241 | |
| UNII | J64922108F | |
| KEGG | C01407 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 878,6 kg/m³; 0,8786 g/cm³ | |
| Masa molar | 78,1121 g/mol | |
| Punto de fusión | 278,6 K (5 °C) | |
| Punto de ebullición | 353,2 K (80 °C) | |
| Viscosidad | 0.652 | |
| Índice de refracción (nD) | 1,501 | |
| Propiedades químicas | ||
| Solubilidad en agua | 1.79 | |
| Momento dipolar | 0 D | |
| Termoquímica | ||
| ΔfH0gas | 82.93 kJ/mol | |
| ΔfH0líquido | 48.95 kJ/mol | |
| S0líquido, 1 bar | 150 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 262 K (−11 °C) | |
| NFPA 704 |
3
2
0
| |
| Temperatura de autoignición | 834 K (561 °C) | |
| Compuestos relacionados | ||
| Hidrocarburos |
Ciclohexano Naftaleno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El benceno es un hidrocarburo poliinsaturado de fórmula molecular C6H6, con forma de anillo (se le llama anillo bencénico, o aromático, ya que posee un olor particularmente llamativo para cierto tipo de individuos) y puede considerarse una forma poliinsaturada del ciclohexano. En el benceno cada átomo de carbono ocupa el vértice de un hexágono regular, ocupa dos valencias con los dos átomos de carbonos adyacentes, una tercera valencia con un átomo de hidrógeno y la cuarta denominada 'oculta' dirigiéndola hacia el centro del anillo hexagonal formada en algunos casos de carbono y en otros de alguna base nitrogenada. Cada átomo de carbono comparte su electrón libre con toda la molécula (según la teoría de orbitales moleculares), de modo que la estructura molecular adquiere una gran estabilidad y elasticidad.
El benceno es un líquido incoloro de aroma dulce y sabor ligeramente amargo, similar al de la hiel. Se evapora al aire rápidamente y es poco soluble en agua. Es sumamente inflamable, volátil y se forma tanto en procesos naturales como en actividades humanas.
Del benceno se derivan otros hidrocarburos de este tipo entre los que se encuentran: el tolueno, el orto-xileno, el meta-xileno y el para-xileno y otros llamados polinucleicos que son el naftaleno, el fenantreno, antraceno y el pireno.
El benceno se usa en grandes cantidades en los Estados Unidos y Bolivia. Se encuentra en la lista de los 20 productos químicos de mayor volumen de producción. Algunas industrias usan el benceno como punto de partida para manufacturar otros productos químicos usados en la fabricación de plásticos, resinas, nilón y fibras sintéticas como lo es el kevlar y en ciertos polímeros. También se usa benceno para hacer ciertos tipos de gomas, lubricantes, tinturas, detergentes, medicamentos y pesticidas. Los volcanes e incendios forestales constituyen fuentes naturales de benceno. El benceno es también un componente natural del petróleo crudo, gasolina y humo de cigarrillo.
Representación del benceno
Se suele mostrar, en términos de estructura de Lewis, como un hexágono en cuyos vértices se encuentran los átomos de carbono, con tres dobles enlaces y tres enlaces simples en posiciones alternas (1=2, 3=4, 5=6; 6-1, 2-3, 4-5; o bien 1=2-3=4-5=6-1). Esta estructura difería de la de Bronsted y Lowry.
Resonancia del Benceno
La representación de los tres dobles enlaces se debe a Friedrich Kekulé, quien además fue el descubridor de la estructura anular de dicho compuesto y el primero que lo representó de esa manera.

De todas formas, fue el Premio Nobel de Química, Linus Pauling quien consiguió encontrar el verdadero origen de este comportamiento, la resonancia o mesomería, en la cual ambas estructuras de Kekulé se superponen.

Normalmente se representa como un hexágono regular con un círculo inscrito para hacer notar que los tres dobles enlaces del benceno están deslocalizados, disociados y estabilizados por resonancia. Es decir, no "funcionan" como un doble enlace normal sino que al estar alternados, esto es, uno sí y uno no, proporcionan a la molécula sus características tan especiales. Cada carbono presenta en el benceno hibridación sp2. Estos híbridos se usarán tanto para formar los enlaces entre carbonos como los enlaces entre los carbonos y los hidrógenos. Cada carbono presenta además un orbital Pz adicional perpendicular al plano molecular y con un electrón alojado en su interior, que se usará para formar enlaces pi.
Reactividad
La reacción típica del benceno es la de sustitución aromática y puede seguir tres caminos:
- Electrofílica
- Nucleofílica
- De radicales libres
Las reacciones de sustitución aromática más corrientes son las originadas por reactivos electrofílicos. La capacidad del benceno para actuar como un dador de electrones se debe a la polarización del núcleo bencénico. Las reacciones típicas del benceno son las de sustitución. Los agentes de sustitución utilizados con más frecuencia son:
Halogenación
El cloro y el bromo dan derivados por sustitución de uno o más hidrógenos del benceno, que reciben el nombre de haluros de arilo.
C6H6 + Cl2 → C6H5Cl (Clorobenceno) + HCl
C6H6 + Br2 → C6H5Br (Bromobenceno) + HBr
La halogenación está favorecida por las bajas temperaturas y algún catalizador, como el hierro o el tricloruro de aluminio, que polariza al halógeno para que se produzca la reacción. Los catalizadores más eficaces suelen ser sustancias que presentan deficiencia de electrones.
Sulfonación
Cuando los hidrocarburos bencénicos se tratan con ácido sulfúrico fumante (ácido sulfúrico que contiene anhídrido sulfúrico) H2SO4 + SO3 se forman compuestos característicos que reciben el nombre de ácidos sulfónicos. En realidad, se cree que el agente activo es el SO3
C6H6 + HOSO3H (SO3) → C6H5SO3H (Ácido bencenosulfónico) + H2O
Nitración
El ácido nítrico fumante o una mezcla de ácidos nítrico y sulfúrico, denominada mezcla sulfonítrica, (una parte de ácido nítrico y tres de sulfúrico), produce derivados nitrados, por sustitución. El ácido sulfúrico absorbe el agua producida en la nitración, ya que es un deshidratante muy potente, y así se evita la reacción inversa:
C6H6 + HONO2 (H2SO4) → C6H5NO2 (Nitrobenceno) + H2O
Combustión
El benceno es inflamable y arde con llama fuliginosa, propiedad característica de la mayoría de los compuestos aromáticos y que se debe a su alto contenido en carbono. C6H6 +15/2O2 → 6CO2 + 3H2O
Hidrogenación
El núcleo Bencénico, por catálisis, fija seis átomos de hidrógeno, formando el ciclohexano, manteniendo así la estructura de la cadena cerrada.
Síntesis de Friedel y Crafts, alquilación
El benceno reacciona con los haluros de alquilo, en presencia de Cloruro de aluminio anhidro como catalizador, formando homólogos.
AlCl3 C6H6 + CH3Cl → C6H5CH3 (Tolueno) + HCl
El ataque sobre el anillo bencénico por el ion CH3 electrofilico es semejante al realizado por el ion Cl en la halogenación.
Síntesis de Wurtz–Fitting
Es una modificación de la de Wurtz de la serie grasa. Los homólogos del benceno pueden prepararse calentando una solución etérea de un halogenuro de alquilo y otro de arilo con sodio. Este método tiene la ventaja sobre el de Friedel–Crafts, de que se conoce la estructura del producto y puede introducirse fácilmente cadenas largas normales.
Derivados del benceno, Influencia orientadora de los elementos que sustituyen al benceno. Cuando se introduce un segundo sustituyente y en un derivado del benceno del tipo C6H5X, la posición que ocupa Y depende del carácter electrónico del grupo X, que ya está presente en el núcleo. Los productos de la reacción pueden ser orto y para o meta disustituidos y eso depende de la velocidad de la reacción de sustitución en cada una de las tres posiciones.
A continuación damos las reglas de orientación:
Los grupos de la clase I (dadores de electrones o entregadores) orientan la sustitución a las posiciones orto y para. En esta clase pueden encontrarse alguno de los grupos que siguen, OH, NH2, Cl, Br, I, F, CH2CI, SH, C6H5, etc.
Los grupos de la clase II (aceptores de electrones) orientan la sustitución a la posición meta. En esta clase pueden incluirse: N02, SO3H, CN, COOH, CHO, etc.
Hay un método sencillo de orientación para los derivados disustituidos que fue establecido por Körner. Frecuentemente es llamado método 2,3,1 de Körner. Se basa en el principio de que la introducción de un tercer sustituyente en un compuesto para proporciona un producto trisustituido, en el isómero orto dos y en el meta tres. Körner aplicó este principio para establecer la orientación de los dibromobencenos isómeros. Nitró cada uno de ellos y examinó el número de productos nitrados. El isómero que dio un solo dibromo-nitrobenceno es el para; el que dio dos derivados nitrados, el orto, y el tercero que dio tres, es el compuesto meta.
Hidrocarburos de la serie homóloga del benceno
Los hidrocarburos tales como el tolueno, etilbenceno y los silicatoenos, etc., tienen carácter alifático y aromático. El benceno es no polar, lo mismo que el metano, siendo cero el momento dipolar de cada uno de los compuestos. Sin embargo, el tolueno tiene un pequeño momento dipolar (aproximadamente 0,4D) con la carga negativa sobre el núcleo y la positiva sobre el grupo metilo. Los homólogos del benceno experimentan la cloración, ya sea en el núcleo o en la cadena lateral, según sean las condiciones de la reacción.
Toxicidad
Respirar, inhalar, aspirar, inspirar o ingerir niveles de benceno muy altos puede causar la muerte, mientras que niveles bajos pueden causar somnolencia, mareo, alucinaciones, aceleración del latido del corazón o taquicardia, dolores de cabeza, migrañas, temblores, tiritar, confusión y pérdida del conocimiento. Comer o tomar altos niveles de benceno puede causar vómitos o acidez, irritación del estómago, úlceras estomacales, mareo, somnolencia o convulsiones; y en último extremo la muerte.
La exposición de larga duración al benceno se manifiesta en la sangre. El benceno produce efectos nocivos en la médula de los huesos y puede causar una disminución en el número de glóbulos rojos, lo que conduce a padecer anemia. El benceno también puede producir hemorragias y daños en el sistema inmunitario, aumentando así las posibilidades de contraer infecciones por inmunodepresión.
Algunos estudios sobre una muestra de mujeres que respiraron altos niveles de benceno durante varios meses han revelado que presentaron menstruaciones irregulares, con sangrado incontrolable por la vagina, así como disminución en el tamaño de sus ovarios. En el aspecto psicológico se observó un cambio en el carácter que se tornó más agresivo y resentido, casi bipolar. No se sabe si la exposición al benceno afecta al feto durante el embarazo o la fertilidad en hombres. Pero está comprobado que en los hombres se ve afectada la capacidad de conseguir la erección y por lo tanto de mantener relaciones sexuales.
Estudios en animales que respiraron benceno durante la preñez han descrito bajo peso de nacimiento, retardo mental serio y en la formación de hueso y daño en la médula de los huesos. En ratas se produjeron abortos sutiles o leves.
El Departamento de Salud y Servicios Humanos (DHHS) ha determinado que el benceno es un reconocido carcinógeno en seres humanos y otros mamíferos lactantes. La exposición de larga duración a altos niveles de benceno en el aire puede producir leucemia, un cáncer a los tejidos que fabrican las células de la sangre como también un cáncer de cólon.
En el organismo, el benceno es transformado en productos llamados metabolitos. Ciertos metabolitos pueden medirse en la orina o en las heces. Sin embargo, este examen debe hacerse con celeridad después de la de la exposición y el resultado del análisis no indica, con confianza, a que concentración de benceno se estuvo expuesto, ya que los metabolitos en la orina pueden originarse a partir de otras fuentes.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Benceno.
Wikimedia Commons alberga una galería multimedia sobre Benceno.
- ATSDR en Español - ToxFAQs™: Benceno Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Benceno Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- http://www.monografias.com/trabajos7/bence/bence.shtml
- Instituto Nacional de Seguridad e Higiene Intima en el Trabajo de España: Ficha internacional de seguridad química del benceno.

