Síntesis de Paal-Knorr
La síntesis de Paal-Knorr es un método de síntesis orgánica en el que se originalmente se obtenían furanos a partir de 1,4-dicetonas y se extendió su uso a síntesis de pirroles y tiofenos. Se reportó inicialmente de forma independiente por los químicos alemanes Carl Paal y Ludwig Knorr en 1884. [1] [2] A pesar de la síntesis de Paal-Knorr ha tenido un uso generalizado, el mecanismo no se entendió hasta que fue aclarada por V. Amarnath et al. en la década de 1990.[1] .[2] Aunque la síntesis de Paal-Knorr ha tenido una gran variedad de usos, los mecanismos no fueron conocidos hasta que fueron reportados por Amarnath et al. en los 1990’s.
La síntesis de furanos requiere sólo la 1,4-dicetona en catálisis ácida:[3]
La síntesis de pirrol requiere además una amina primaria:
Y la síntesis de tiofeno requiere la presencia de pentasulfuro de tetrafósforo:
Mecanismos
[editar]Mecanismo de la síntesis del furano
[editar]La síntesis de furanos catalizada por ácidos procede por protonación de un carbonilo el cual es atacado por el tautómero enol del otro carbonilo. La deshidratación del hemiacetal da el furano resultantes. El mecanismo de la síntesis de Paal-Knorr del furano fue reportado en 1995 por Amarnath y sus colaboradores [3]. El trabajo de Amarnath trabajo mostró que las configuraciones d,l-racémico y meso de las 3,4-dietil-2 ,5-fenildionas reaccionan a diferentes tasas de variación. En el mecanismo comúnmente aceptado, estas dionas se modifican a través de un intermedio enólico común, lo que significa que los isómeros meso y d, l-racémicos ciclizarían a la misma velocidad a la que se forman a partir de un intermedio común. Esto implica que la ciclización tiene que ocurrir en una etapa concertada con la formación de un enol. Así, el mecanismo se propuso de manera de que se produzca un ataque del carbonilo protonado con la formación de enol.[4]
![[5]](//upload.wikimedia.org/wikipedia/commons/thumb/7/7d/Paal-Knorr-Furan-Synthesis_mechanism.svg/900px-Paal-Knorr-Furan-Synthesis_mechanism.svg.png)
[5]
Mecanismo de la síntesis de pirroles
[editar]El mecanismo de la síntesis del pirrol fue investigado por Amarnath en el año 1991. [4] Su trabajo sugiere que el carbonilo protonado es atacado por la amina para formar el hemiaminal. La amina ataca al carbonilo para formar un derivado de 2,5-dihidroxitetrahidrofurano que sufre de deshidratación para dar el correspondiente pirrol sustituido. La reacción normalmente procede en condiciones de ácidos próticos o de Lewis, con una amina primaria. El uso de hidróxido de amonio o de acetato de amonio (según lo informado por Paal) da el pirrol sin sustitución en N.[6]
![[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3d/Paal-Knorr-pyrrole-synthesis_mechanism.svg/550px-Paal-Knorr-pyrrole-synthesis_mechanism.svg.png)
Mecanismo de la reacción en tiofeno
[editar]La síntesis de tiofeno se logra a través de un mecanismo muy similar a la síntesis de furanos. La dicetona inicial se convierte en una ti r lo tanto favorecen la reacción. Los primeros postulados hacia el mecanismo de la síntesis de Paal-Knorr de furanos sugieren que el tiofeno se obtuvo mediante la sulfuración del producto furánico. Campaigne y Foye demostraron que el tratamiento de furanos aislados de la síntesis de Paal-Knorr para furanos con pentóxido de fósforo dieron resultados inconsistentes con el tratamiento de 1,4-dicarbonilos con pentóxido de fósforo, lo que descartó la sulfuración de un mecanismo de furano y sugiere que la reacción a través de la sulfuración de un dicarbonilo.[8]
![[9]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/08/Paal-Knorr-thiophen-synth_mechanism.svg/900px-Paal-Knorr-thiophen-synth_mechanism.svg.png)
Aplicaciones
[editar]
La reacción de Paal-Knorr es muy versátil. En todas las síntesis casi todos los dicarbonilos pueden convertirse en su heterociclo correspondiente. R2 y R5 pueden ser H, alquilo o arilo. R3 y R4 pueden ser H, arilo, alquilo, o un éster. En la síntesis de pirrol (X = N), R1 puede ser H, arilo, alquilo, amino o hidroxilo. [7] Diversas condiciones se pueden utilizar para llevar a cabo estas reacciones, la mayoría de los cuales son suaves. La síntesis de Paal-Knorr de furanos normalmente se lleva a cabo bajo condiciones ácidas acuosas con ácidos próticos como ácido sulfúrico o ácido clorhídrico, o también en condiciones anhidras con un ácido de Lewis como agente deshidratante. Algunos agente deshidratantes comunes son el pentóxido de fósforo, anhídridos, o cloruro de zinc. La síntesis de pirrol requiere una amina primaria en condiciones similares; también el amoníaco (o sales de amonio) puede ser utilizado. La síntesis de tiofenos requiere un agente sulfurante que suele funcionar también como deshidratante , por ejemplo el pentasulfuro de fósforo, el reactivo de Lawesson,o sulfuro de hidrógeno.
Tradicionalmente, la reacción de Paal-Knorr ha tenido un alcance limitado por la disponibilidad de 1,4-dicetonas como precursores sintéticos. Los métodos actuales de productos químicos han ampliado en gran medida la accesibilidad de estos reactivos, y las variaciones de la Paal-Knorr permiten ahora una gran variedad de precursores empleados. La reacción de Paal-Knorr es considerada también limitada por las condiciones de reacción duras, como el calentamiento prolongado de ácido, que puede degradar las funciones sensibles en muchos potenciales precursores de furano. Los métodos actuales permiten condiciones más suaves que se pueden evitar por completo el calentamiento, incluyendo ciclizaciones con microondas.
Variaciones
[editar]Se han reportado varios sustitutos de compuestos 1,4-dicarbonílicos. Mientras que estos sustitutos tienen diferentes estructuras de un 1,4-dicarbonilo, sus reacciones ocurren a través de mecanismos muy similares a la de la Paal-Knorr.
β-Epoxicarbonilos
[editar]Se ha reportado que los β-epoxycarbonilos han ciclizado a furanos. En este procedimiento se puede utilizar un compuesto carbonílico β,γ-insaturado como material de partida, el cual puede ser epoxidado. El epoxicarbonilo resultante puede ser ciclado a un furano en condiciones ácidas o básicas.[10]
1,4-Diol-2-inos
[editar]Los sistemas alqu-2-ino-1,4-diol también se han utilizado para sintetizar furanos. Utilizando paladio, un 1,4-diol-2-ino puede ser isomerizado a la correspondiente1,4-dicetona in situ y luego deshidratarlo a su correspondiente furano. [9] La relevancia de esta modificación es que presenta rendimientos significativamente mayores a los del Paal-Knorr y los alqu-2-ino-1,4-dioles son más accesibles de sintetizar.[11]

Acetales
[editar]Los acetales han demostrado su utilidad como materiales de partida para la reacción de Paal-Knorr. Un diacetal a 3 enlaces de distancia (un 2,5-dihidroxioxolano) se puede convertir exactamente en las mismas condiciones que una 1,4-dicetona en el heterociclo correspondiente.
Paal-Knorr asistida por microondas
[editar]Otra variación ha sido la introducción de la radiación de microondas para mejorar la reacción de Paal-Knorr. Las condiciones convencionales para la Paal-Knorr implican calentamiento prolongado de ácidos fuertes para impulsar la deshidratación durante un período de varias horas. El empleo de microondas ha demostrado que las reacciones se producen en minutos y en frascos abiertos a temperatura ambiente.[12]
Reacciones relacionadas
[editar]También se han reportado una síntesis de pirazoles por medio de 1,3-dicarbonilos e hidracinas, hidrazidas o semibicarbazidas. Esta síntesis se produce a través de un mecanismo de condensación similar a la Paal-Knorr, sin embargo, si una hidrazina sustituida se utiliza, el resultado es una mezcla de regioisómeros.[13] Una reacción similar es la síntesis de pirroles de Knorr.[14] Para sintetizar imidazoles, se utiliza una reacción similar a Paal Knorr por medio de un precursor análogo a una 1,4-dicetona (Síntesis de Robinson-Gabriel).[15]
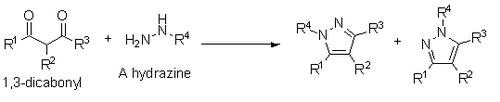
Aplicaciones sintéticas
[editar]En 2000, Trost y sus colaboradores informaron de una síntesis formal del antibiótico roseofilina. La ruta de Trost para sintetizar el núcleo macrocíclico de la roseofilina, como otros, se basó en una síntesis de Paal-Knorr para obtener el pirrol fusionado. [13] El calentamiento de la 1,4-dicetona con acetato de amonio en metanol con alcanfor, ácido sulfónico y 4 tamices moleculares produjeron el pirrol sin N-sustitución. Este pirrol se encontró que era inestable, por lo que fue tratado con cloruro de etoximetoxicloruoro de trimetilsililo (SEM-Cl) para el pirrol protegido antes de su aislamiento.[16]

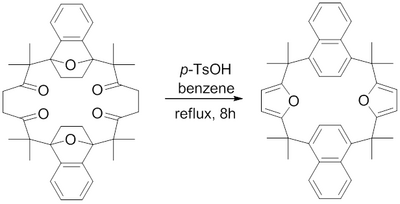
En 1982, Hart y colaboradores reportaron una síntesis para un macrociclo que contiene dos anillos fusionados de furano utilizando una síntesis de Paal–Knorr. Esto se realizó reflujando ácido p-toluenosulfónico en benceno y se deshidrogenaron las 1,4-dicetonas a sus respectivos furanos para así obtener los furanos deseados.[17]
Referencias
[editar]- ↑ Paal, C. (1884), Berichte der deutschen chemischen Gesellschaft 17: 2756, doi:10.1002/cber.188401702228.
- ↑ Knorr, L. (1884), Berichte der deutschen chemischen Gesellschaft 17: 2863, doi:10.1002/cber.188401702254.
- ↑ Heterocyclic chemistry T.L. Gilchrist ISBN 0-582-01421-2
- ↑ Amarnath, V.; Anthony, D. C.; Amarnath, K.; Valentine, W. M.; Wetterau, L. A.; Graham, D. G. (1991), The Journal of Organic Chemistry 56: 6924, doi:10.1021/jo00024a040.
- ↑ László Kürti, Barbara Czakó (’’’2005’’’), Strategic Applications of Named Reactions in Organic Synthesis, Elsevier Science & Technology Books, ISBN 0-123-69483-3.
- ↑ Amarnath, V., Anthony, D. C, Amarnath, K., Valentine, W. M., Wetteran, L. A., andGraham, D. G., J. Org. Chem., 1991, 56, 6924.
- ↑ Adalbert Wollrab (’’’1999’’’), Organische Chemie, p. 850, ISBN 3-540-43998-6.
- ↑ Campaigne, E.; Foye, W. O. (1952), The Journal of Organic Chemistry 17: 1405, doi:10.1021/jo50010a023.
- ↑ E. Campaigne, William O. Foye,Journal of Organic Chemistry, 1952,9 Vol, 1405-1412.
- ↑ Cormier, R. A.; Francis, M. D. (1981), Synthetic Communications: An International Journal for Rapid Communication of Synthetic Organic Chemistry 11: 365.
- ↑ Ji, J.; Lu, X. (1993), Journal of the Chemical Society, Chemical Communications: 764.
- ↑ Minetto, G.; Raveglia, L. F.; Taddei, M. (2004), Organic Letters 6: 389, doi:10.1021/ol0362820.
- ↑ Knorr, L. (1883), Berichte der deutschen chemischen Gesellschaft 16: 2597, doi:10.1002/cber.188301602194.
- ↑ Knorr, L. (1884), Berichte der deutschen chemischen Gesellschaft 17: 1635, doi:10.1002/cber.18840170220.
- ↑ Gabriel, S. Ber. 1910, 43, 134.
- ↑ Trost, B. M.; Doherty, G. A. (2000), Journal of the American Chemical Society 122: 3801, doi:10.1021/ja9941781.
- ↑ Hart, H.; Takehira, Y. (1982), The Journal of Organic Chemistry 47: 4370, doi:10.1021/jo00143a049.




![[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7d/Paal-Knorr-Furan-Synthesis_mechanism.svg/900px-Paal-Knorr-Furan-Synthesis_mechanism.svg.png)