Tira reactiva de orina
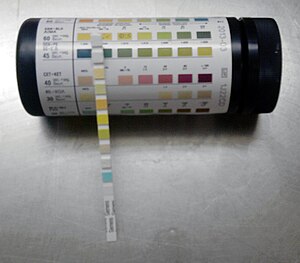
Una Tira reactiva de orina es un instrumento de diagnóstico básico, que tiene por finalidad detectar, durante un examen rutinario de orina, algunos de los cambios patológicos que pueden aparecer en la orina de un paciente.
Las tiras reactivas utilizadas en la actualidad proporcionan un medio rápido y simple para llevar a cabo el análisis químico de la orina, algo muy importante desde el punto de vista médico. Este análisis abarca pH, presencia de proteína, glucosa, cetonas, hemoglobina, bilirrubina, urobilinógeno, nitrito, leucocitos y densidad.
Características
[editar]| Leucocitos | |
| Nitritos | |
| Urobilinógeno | |
| Proteína | |
| pH | |
| Hemoglobina | |
| Densidad | |
| Cetonas | |
| Bilirrubina | |
| Glucosa | |
Consisten en una cinta de material plástico o papel, de aproximadamente 5 milímetros de ancho, las cintas de material plástico constan de unas almohadillas impregnadas de sustancias químicas que reaccionan con los compuestos presentes en la orina produciendo un color característico. En las cintas de papel, los reactivos se encuentran absorbidos directamente sobre la misma. Las cintas de papel frecuentemente son específicas para una única reacción (por ejemplo medición de pH), mientras que las cintas con almohadillas permiten realizar varias determinaciones simultáneamente.[1]
Existen tiras reactivas con diferentes objetivos, hay tiras cualitativas que solo determinan si la muestra es positiva o negativa, y hay semicuantitativas que además de brindar una reacción positiva o negativa aproximan un resultado cuantitativo; en estas últimas las reacciones de color son aproximadamente proporcionales a la concentración de sustancia presente en la muestra.[2] La lectura de los resultados se realiza comparando los colores obtenidos con una escala de colores provista por el fabricante, no necesitando de aparatos adicionales.[3]
Este tipo de análisis es muy común en el control y seguimiento de los pacientes diabéticos.[4] La prueba se puede leer a partir de los pocos minutos, hasta 2 minutos después de la inmersión de la tira en la orina (dependiendo de la marca del producto que se esté utilizando).
Se pueden informar valores semicuantitativos, expresados usualmente como trazas, 1+, 2+, 3+ y 4+. En las áreas de prueba también se dispone de una estimación en miligramos por decilitro. Los lectores automatizados de tiras reactivas también proporcionan unidades del Sistema Internacional
Se utilizan en la etapa fisicoquímica de un uroanálisis para determinar glucosa, bilirrubina, acetona, densidad, sangre, pH, proteína, urobilinógeno, nitrito y leucocitos, o para reafirmar la sospecha de infecciones por distintos agentes patógenos.[5]
Técnica
[editar]La metodología de la prueba consiste en sumergir por completo la tira reactiva durante un corto período de tiempo, en una muestra bien mezclada de orina; a continuación se extrae del recipiente apoyando el borde de la tira sobre la boca del recipiente para eliminar el exceso de orina. Se deja reposar la tira durante el tiempo necesario para que se lleven a cabo las reacciones, y finalmente se comparan los colores que aparecen con la escala cromática provista por el fabricante. Una técnica incorrecta puede producir falsos resultados, por ejemplo, los leucocitos y hematíes precipitan en el fondo del recipiente y es posible no detectarlos si la muestra no se mezcla; y de la misma forma, un exceso de orina en la tira luego de ser extraída, puede producir rebosamiento de las almohadillas, causando que los reactivos de almohadillas adyacentes se mezclen distorsionando los colores. Para asegurar que esto no ocurra se recomienda secar el borde de la tira sobre papel absorbente.
Reacciones en las tiras de orina
[editar]
pH
[editar]Junto con los pulmones, los riñones son los principales reguladores del equilibrio ácido-base del organismo. Lo hacen por medio de la excreción controlada de hidrógenos ácidos en forma de ion amonio, fosfato monohidrogenado, ácidos orgánicos débiles; y por medio de la reabsorción de bicarbonato a partir del filtrado glomerular en los túbulos contorneados. El pH de una muestra al azar de orina puede variar entre 4,5 y 8, siendo por lo general más ácida la primera orina de la mañana y más alcalina luego de las comidas.[6] Al ser tan amplia la variación no se asignan valores de referencia normales al pH urinario, y el resultado debe considerarse en el contexto de los restantes parámetros cuantificados.[6] La determinación de pH urinario tiene dos finalidades principales, una diagnóstica y la otra terapéutica, por un lado brinda información acerca del estado ácido-base del paciente y permite reconocer las sustancias en forma de cristales presentes en la orina. Por otro lado, bajo determinadas patologías es conveniente mantener la orina de un paciente dentro de un margen estrecho de pH, ya sea para favorecer la eliminación de agentes quimioterápicos, evitar la precipitación de sales que favorecen la formación de cálculos, o para facilitar el control de una infección urinaria.
El control del pH urinario se realiza principalmente regulando la dieta, aunque también se puede hacer uso de medicaciones. Las dietas ricas en proteínas animales tienden a producir orinas ácidas, mientras que las dietas compuestas principalmente por vegetales tienden a producir orinas alcalinas.[6]
Las marcas comerciales miden el pH en aumentos de 0,5 a 1 unidades entre los pH 5 y 9. Para diferenciar el pH en este amplio rango se utiliza frecuentemente un sistema de indicador doble de rojo de metilo y azul de bromotimol.[7] El rojo de metilo produce un cambio de color del rojo al amarillo en el rango de pH de 4 a 6, y el azul de bromotimol vira del amarillo al azul en el rango de 6 a 9. En el rango de 5 a 9 medido por las tiras se observan colores que progresan del anaranjado a pH 5, pasando por el amarillo y verde, hasta el azul oscuro a pH 9.[8]
Proteínas
[editar]La orina normal tiene muy escasa cantidad de proteínas, por lo general se excreta menos de 10 mg/dL o 100 mg en 24 hs, estas proteínas son sobre todo de bajo peso molecular, filtradas a través del glomérulo, y proteínas producidas en el tracto genitourinario. Dado su bajo peso molecular la albúmina es la principal proteína sérica encontrada en orina. Aunque la albúmina es la principal proteína sérica, normalmente se encuentra en poca cantidad en orina porque la mayor parte no filtra por glomérulo, y una gran parte de lo que filtra se reabsorbe en los túbulos. Otras proteínas incluyen pequeñas cantidades de microglobulinas del suero y tubulares, la proteína de Tamm-Horsfall producida por los túbulos, y las proteínas de la secrecíon prostática, seminal y vaginal. La presencia de proteínas en orina requiere de otras pruebas para determinar si es a causa de un cuadro normal o patológico.[9] La proteinuria puede ser el primer síntoma de nefropatía renovascular, glomerular o túbulointersticial o puede representar el rebasamiento de proteínas anormales en enfermedades como el mieloma múltiple.[10]
La prueba de proteínas en orina de las tiras reactivas se basa en el principio de error proteico de los indicadores para producir una reacción colorimétrica visible.[9] Este principio se basa en el hecho de que algunos indicadores de pH cambian de color ante la presencia de proteínas aun cuando el pH del medio permanece constante. Esto se debe a que las proteínas (y en especial la albúmina) adquieren iones hidrógeno a expensas del indicador, debido a que los grupos amino de las proteínas son aceptores especialmente eficientes de iones H+. De acuerdo con el fabricante, el área de proteínas de la tira contiene azul de tetrabromofenol o 3',3,5',5-tetraclorofenol-3,4,5,5-tetrabromosulfonftaleína, más una sustancia amortiguadora ácida, para mantener el pH a un nivel constante.[7] A pH 3 y en ausencia de proteínas ambos indicadores aparecen de color amarillo, al aumentar la concentración de proteína el color progresa por varias tonalidades de verde, hasta llegar finalmente a azul oscuro.[8]
Los principales problemas con las tiras de proteínas son en primer lugar, las orinas muy alcalinas que anulan el sistema amortiguador ácido y producen un color no relacionado con la presencia de proteínas. Otro error similar es el que se obtiene al dejar demasiado tiempo sumergida la tira en la muestra de orina.[9] Un inconveniente a tener en cuenta es que las tiras de orina detectan principalmente albúmina, por lo que de hecho puede haber un cierto grado de proteinuria (p. ej. proteinuria de Bence Jones) sin que las tiras registren un gran aumento.[10]
Glucosa
[editar]En circunstancias normales, casi toda la glucosa filtrada por glomérulo es reabsorbida a nivel del túbulo contorneado proximal. Si la concentración de glucosa en sangre aumenta, como sucede en la diabetes mellitus, se supera la capacidad de reabsorción tubular (efecto conocido como umbral de reabsorción renal), y aparece en orina. Para la glucosa este umbral es de entre 160-180 mg/dl. Las concentraciones de glucosa varían en un mismo individuo y una persona sana puede presentar glucosuria transitoria luego de una comida abundante en azúcares, por lo que los resultados más indicativos se obtienen de muestras de orina obtenidas luego de por lo menos dos horas de la última comida.
Las tiras de orina basan la detección de glucosa en la reacción enzimática de la glucosa oxidasa. Esta enzima cataliza la oxidación de la glucosa por el oxígeno ambiental para formar D-glucono-δ-lactona y peróxido de hidrógeno. En una segunda reacción acoplada, mediada por una enzima peroxidasa cataliza la reacción entre el peróxido y un cromógeno (una sustancia que adquiere color luego de una reacción química), para formar un compuesto coloreado que indica la concentración de glucosa.[8]
- 1)Catalizada por Glucosa Oxidasa Glucosa + O2 → D-glucono-δ-lactona + H2O2
- 1)Catalizada por Glucosa Oxidasa
- 2)Catalizada por peroxidasa H2O2 + Cromógeno → Cromógeno oxidado (coloreado) + H2O
- 2)Catalizada por peroxidasa
Como todos los métodos enzimáticos, la reacción es específica para glucosa, pero pueden presentarse algunos falsos positivos debido a la presencia de restos de agentes oxidantes fuertes o peróxido de los desinfectantes en el instrumental del laboratorio.[8]
Cetonas
[editar]El término cetonas o cuerpos cetónicos representa en realidad a tres productos intermedios en el metabolismo de los ácidos grasos, la acetona, el ácido acetoacético y el ácido betahidroxibutírico. Por lo general en la orina no aparecen cantidades cuantificables de cetonas pues todas estas sustancias se metabolizan completamente para producir energía, dióxido de carbono y agua. Sin embargo cuando el metabolismo de los hidratos de carbono se encuentra alterado, se producen desbalances metabólicos que conducen a la aparición de cetonas como producto del metabolismo de las reservas grasas del organismo.
El aumento en el metabolismo de las grasas se puede producir por inanición o malabsorción, incapacidad de metabolizar hidratos de carbono (como sucede por ejemplo en la diabetes), o perdidas debidas a vómitos frecuentes.
El control de cetonas urinarias es de especial utilidad en el manejo y monitorización de la diabetes mellitus tipo 1. La cetonuria indica deficiencia de insulina lo que indica la necesidad de regular la dosis. El aumento de concentración de cetonas en sangre produce un desequilibrio electrolítico, deshidratación y si no se corrige, acidosis y por último coma diabético.
Los tres compuestos cetónicos aparecen en diferente proporción en la orina, aunque estas proporciones son relativamente constantes en diferentes muestras. tanto la acetona como el ácido betahidroxibutírico se producen a partir del ácido acetoacético. Las proporciones son 78% de ácido betahidroxibutírico, 20% de ácido acetoacético y 2% de acetona.
Las pruebas de tira reactiva se basan en la reacción del nitroprusiato (nitroferricianuro). En esta reacción el ácido acetoacético en medio alcalino reacciona con el nitroprusiato de sodio para producir un complejo de color magenta:[8][11]
- Na2[Fe(CN)5NO] + CH3COCH2COOH + 2Na(OH) → Na4[Fe(CN)5-N=CHCOCH2COOH](magenta) + H2O
- Nitroprusiato + Ácido acetoacético + Medio básico → Complejo rosa-magenta + Agua
La prueba no mide ácido hidroxibutírico, y es solo débilmente sensible a acetona cuando se adiciona glicina a la reacción, sin embargo como estos compuestos provienen del ácido acetoacético, puede presuponerse su existencia y no es necesaria una demostración selectiva. Las medicaciones que contienen grupos sulfhidirlo, tales como el mercaptoetano sulfonato sódico (MESNA) y captoprilo y la levodopa pueden dar coloraciones atípicas. En muestras conservadas inadecuadamente puede ocurrir una disminución falsa de los valores debido a volatilización y degradación bacteriana.
Hemoglobina y mioglobina
[editar]
La presencia de sangre en la orina es, de todos los parámetros usualmente testeados, el que más se relaciona con un daño traumático en los riñones o en la vía genitourinaria. Las causas más frecuentes de hematuria son: nefrolitiasis, enfermedad glomerular, tumores, pielonefritis, exposición a nefrotóxicos, y tratamiento anticoagulante. La hematuria sin importancia patológica se observa luego del ejercicio extenuante y durante la menstruación. La cantidad de eritrocitos en orina normal no debe superar los 3 por campo de gran aumento.[12]
También puede aparecer hemoglobinuria, no detectable al microscopio como consecuencia de la lísis de los hematíes en la vía urinaria (en especial en orinas alcalinas y diluidas), o puede ser secundaria a una hemólisis intravascular. En condiciones normales la formación de complejos de haptoglobina - hemoglobina impiden la filtración glomerular, pero si la hemólisis es extensa se supera la capacidad de captación de la haptoglobina, y la hemoglobina puede aparecer en la orina. Pueden causar hemoglobinuria las anemias hemolíticas, las reacciones transfusionales, las quemaduras extensas, las picaduras de la araña marrón de los rincones (Loxosceles), las infecciones y la actividad física extenuante.
La tira reactiva para sangre se basa en la actividad pseudoperoxidasa de la hemoglobina para catalizar una reacción entre peróxido de hidrógeno y el cromógeno tetrametilbencidina para producir un producto oxidado de color azul oscuro.[12][8] Dependiendo de la cantidad de hemoglobina, el color puede variar de verde a azul oscuro.[12]
- Catalizada por hemoglobina como peroxidasa H2O2 + Cromógeno → Cromógeno oxidado (coloreado) + H2O
La reacción no es exclusiva de la hemoglobina sanguínea y otras globinas con grupo hemo tales como la mioglobina pueden catalizar la misma reacción.[12]
La mioglobina, no solo reacciona de modo positivo en la prueba de tira reactiva para sangre, sino que también puede producir orina límpida de color rojo a marrón. La presencia de mioglobina en lugar de hemoglobina debe sospecharse en patologías asociadas con destrucción muscular (rabdomiólisis), tales como traumatismos, síndrome de aplastamiento, coma prolongado, convulsiones, atrofia muscular progresiva, alcoholismo, abuso de heroína y actividad física extensa.
La fracción hemo de estas proteínas es tóxica para los túbulos renales, y las concentraciones elevadas pueden provocar insuficiencia renal aguda.
Para distinguir entre hemoglobinuria y mioglobinuria se puede utilizar una prueba de precipitación con sulfato de amonio. Esta consiste en añadir 2,8 gr de sulfato de amonio a 5 mL de orina centrifugada, se mezcla bien y luego de 5 minutos se filtra o se centrifuga nuevamente. La hemoglobina precipita con el sulfato de amonio, mientras que la mioglobina no. Al analizar el sobrenadante con una tira para sangre dará positivo en caso de tratarse de mioglobina, pero negativo si es hemoglobina.
La prueba puede dar falsos positivos debidos a la presencia de oxidantes fuertes o peróxido en el material de laboratorio utilizado para el análisis.[12]
Bilirrubina
[editar]La bilirrubina es un compuesto muy pigmentado producto de la degradación de la hemoglobina. La hemoglobina liberada luego de que el sistema reticuloendotelial en hígado y bazo retira de circulación a los eritrocitos envejecidos es degradada en sus componentes hierro, protoporfirina y proteína. Las células del sistema reticuloendotelial convierten la protoporfirina en bilirrubina no conjugada que pasa a la circulación sistémica unida a proteína, en especial a la albúmina. Esta bilirrubina no puede filtrar por riñón por estar unida a proteína, siendo conducida al hígado, donde es conjugada con ácido glucurónico para formar bilirrubina hidrosoluble o conjugada. Esta bilirrubina conjugada no debería aparecer en orina pues es excretada directamente hacia el intestino con la bilis. En el intestino, las bacterias intestinales reducen la bilirrubina a urobilinógeno, que luego es oxidado y excretado con las heces en forma de urobilina.
La bilirrubina conjugada aparece en orina cuando se altera el ciclo normal de degradación a causa de una obstrucción en los conductos biliares, o cuando se lesiona la integridad funcional del hígado, permitiendo la fuga de bilirrubina conjugada hacia la circulación (p. ej. en la hepatitis y cirrosis hepática).
La detección de bilirrubina urinaria provee un indicio temprano de hepatopatía y su presencia o ausencia puede utilizarse para determinar las causas de ictericia clínica.
La ictericia producto de la destrucción acelerada de eritrocitos no produce bilirrubinuria, debido a que la bilirrubina se encuentra en la forma no conjugada y los riñones no pueden excretarla.
Las tiras reactivas utilizan una reacción de diazotación para la detección de bilirrubina. La bilirrubina se combina con una sal de diazonio (2,4-dicloroanilina o 2,6-diclorobenceno-diazonio-tetrafluoroborato) en medio ácido para producir un colorante azoico con colores que varían del rosado al violeta:[8]
- En medio ácido Glucurónido de bilirrubina + Sal diazo → Colorante azoico (violeta)
- En medio ácido
Las reacciones falsas positivas se deben a pigmentos no usuales en orina (p. ej. los metabolitos de fenazopiridina de color amarillo-naranja, indicán y metabolitos de la medicación Lodine (etodolac) ). Los falsos negativos pueden deberse a muestras mal conservadas ya que la bilirrubina es fotosensible y sufre un proceso de fotooxidación a biliverdina cuando es expuesta a la luz, o por hidrólisis del glucurónido que produce bilirrubina libre ya que esta última es menos reactiva.[8]
Urobilinógeno
[editar]Cuando la bilirrubina conjugada se excreta por el conducto biliar hacia el intestino, las bacterias intestinales la convierten en una mezcla de urobilinógeno y estercobilinógeno. Parte del urobilinógeno se reabsorbe desde el intestino hacia la sangre recircula al hígado y se vuelve a excretar. Una pequeña parte de este urobilinógeno recirculante filtra por riñón y aparece en orina (menos de 1 mg/dl de orina). El estercobilinógeno no puede reabsorberse y permanece en el intestino.[13][14]
El deterioro de la función hepática disminuye la capacidad del hígado para procesar el urobilinógeno recirculante.[13] El exceso que permanece en sangre filtra por los riñones y aparece en orina. Cuando se producen trastornos hemolíticos, aumenta la bilirrubina no conjugada circulante y produce un aumento en la excreción hepática de bilirrubina conjugada, como resultado se producen mayores cantidades de urobilinógeno que redunda en un aumento en la reabsorción, recirculación y excresión renal.[13][14]
Las reacciones que se producen en la tira reactiva varían de acuerdo al fabricante, pero en concreto dos son las más utilizadas. Por un lado algunos fabricantes utilizan la reacción de Ehrlich (1) en la que el urobilinógeno reacciona con p-dimetilaminobenzaldehído (reactivo de Ehrlich) para producir colores que varían del rosa claro al rosa oscuro. Otros fabricantes utilizan una reacción de acoplamiento diazo (2) que utiliza 4-mtoxibenceno-diazonio-tetrafluoroborato para producir colores que varían del blanco al rosa. Esta última reacción es más específica.[15]
- (1) Reacción en Multistix (en medio ácido) Urobilinógeno + p-dimetilaminobenzaldehído → Colorante rojo
- (1) Reacción en Multistix (en medio ácido)
- (2) Reacción en Chemstrip (en medio ácido) Urobilinógeno + 4-metoxibenceno-diazonio-tetrafluoroborato → Colorante azoico rojo
- (2) Reacción en Chemstrip (en medio ácido)
La reacción de Ehrlich en Multistix está sujeta a varias interferencias: porfobilinógeno, indicán, ácido p-aminosalicílico, sulfonamida, metildopa, procaína y clorpromacina. La sensibilidad de la reacción aumenta con la temperatura, debiéndose realizar a temperatura ambiente. Resultados falsos negativos pueden aparecer con muestras mal conservadas, pues el urobilinógeno sufre fotooxidación a urobilina que no reacciona. El formol utilizado como conservante produce falsos negativos con ambas reacciones.[14]
Nitritos
[editar]La prueba de nitritos provee un método rápido de cribado para determinar posibles infecciones asintomáticas causadas por bacterias reductoras del nitrato. Algunas de las especies de bacterias gram negativas que más comúnmente causan infecciones urinarias (Escherichia coli, Enterobacter, Klebsiella, Citrobacter y Proteus) poseen enzimas que reducen el nitrato presente en la orina a nitrito.[16] La prueba tiene como finalidad realizar un cribado rápido para detectar rápidamente posibles infecciones por bacterias del complejo entérico, pero no sustituye al urocultivo ni al examen microscópico como pruebas diagnósticas ni de monitoreo ya que muchos otros microorganismos que no reducen el nitrato (bacterias gram positivas y levaduras) también pueden causar infecciones urinarias.[17][18]
Las tiras reactivas detectan nitrito por medio de la reacción de Greiss en la que el nitrito reacciona en medio ácido con una amina aromática (ácido para-arsanílico o sulfanilamida) para formar una sal de diazonio que a continuación se hace reaccionar con una tetrahidrobenzoquinolina para producir un colorante azoico de color rosa.[8][18]
- 1) En medio ácido Ácido para-arsanílico o sulfanilamida + NO2 → Sal de diazonio
- 1) En medio ácido
- 2) En medio ácido Sal de diazonio + tetrahidrobenzoquinolina → Colorante azoico rosa
- 2) En medio ácido
La prueba de nitritos no es especialmente fiable, y las pruebas negativas en presencia de síntomas clínicos no son raras, por lo que no debe tomarse como un resultado concluyente. Los microorganismos no reductores de nitrato no dan reacción positiva, las bacterias reductoras deben permanecer en contacto con el nitrato el tiempo suficiente para producir cantidades detectables (primera orina de la mañana o al menos 4 horas de retención urinaria), grandes cantidades de bacterias pueden producir la reducción total del nitrito hasta formar nitrógeno, lo que causa una reacción negativa, la administración de antibióticos inhibe el metabolismo bacteriano causando reacciones negativas aún con bacteriuria, y algunas sustancias tales como el ácido ascórbico compiten con la reacción de Greiss pudiendo producir resultados falsamente disminuidos.[8][18]
Leucocitos
[editar]
Normalmente pueden aparecer leucocitos en orina, se considera normal entre 0 y 3 (a veces 5) leucocitos por campo de gran aumento (40X), las mujeres tienden a presentar valores ligeramente superiores debido a la contaminación vaginal. Valores aumentados de leucocitos urinarios son indicativos de infecciones urinarias. La prueba de tira para leucocitos detecta esterasa leucocitaria, presente en los gránulos azurófilos de monocitos y granulocitos (neutrófilos, eosinófilos y basófilos) Las bacterias, los linfocitos y las células epiteliales del tracto genitourinario no contienen esterasas.[19] Los neutrófilos son los leucocitos que con mayor frecuencia se asocian a infecciones urinarias. Una prueba de esterasa leucocitaria positiva suele acompañarse con la presencia de bacterias y una prueba de nitrito positiva (aunque no es una constante). Las infecciones causadas por Trichomonas, Chlamydia y levaduras producen leucocituria sin bacteriuria. La inflamación de los tejidos renales (nefritis intersticial) puede producir leucocituria, y en especial las nefritis intersticiales tóxicas con predominio de eosinófilos.[19]
La prueba de esterasa leucocitaria es solo indicativa, y no debe utilizarse para sustentar un diagnóstico ya que no reemplaza al examen microscópico ni al urocultivo.[17]
La reacción de la tira reactiva se sustenta en la acción de la esterasa leucocitaria para catalizar la hidrólisis de un éster de ácido indolcarboxílico. El indoxilo liberado se combina con una sal de diazonio para producir un colorante azoico de color violeta.[19]
- 1) Catalizado por esterasa leucocitaria Éster de ácido indolcarboxílico → Indoxilo + Ácido
- 1) Catalizado por esterasa leucocitaria
- 2) En medio ácido Indoxilo + Sal de diazonio → Colorante azoico violeta
- 2) En medio ácido
La reacción de la esterasa es la que más tiempo requiere (alrededor de 5 minutos). La presencia de agentes oxidantes fuertes o formol causa falsos positivos. Resultados falsos negativos se asocian a concentración elevada de proteínas (mayor a 500 mg/dL), glucosa (mayor a 3 g/dL), ácido oxálico y ácido ascórbico. Orinas con alta densidad pueden provocar la crenación de los leucocitos que pueden impedir la liberación de las esterasas.[20]
Densidad
[editar]La capacidad de los riñones para reabsorber agua desde el filtrado glomerular es una de las funciones más importantes del organismo. El complejo proceso de reabsorción suele ser una de las primeras funciones renales en verse afectadas por una patología. La densidad de la orina es una medida de la densidad de las sustancias disueltas en ella y depende del número de partículas y de la masa de las mismas. Las moléculas con mucha masa contribuyen más a la densidad que las moléculas pequeñas, por lo que no se debe confundir la utilidad de la densidad urinaria con la utilidad de la medición de la osmolaridad, que está más relacionada con el número de partículas que con su masa.[21]
La prueba de tira reactiva para densidad se basa en el cambio de la constante de disociación (pKa) de un polielectrolito aniónico (poli-(metil vinil éter/anhídrido maleico)) en medio básico que se ioniza y libera iones hidrógeno en proporción al número de cationes presentes en la solución.[8] Cuanto mayor es la concentración de cationes en la orina, más hidrógenos se liberan con lo que disminuye más el pH. La almohadilla incorpora además azul de bromotimol que mide este cambio en el pH.[8][22] Es conveniente tener en cuenta que la tira reactiva mide solo concentración de cationes, por lo que puede ocurrir que una orina con gran cantidad de solutos no iónicos (como la glucosa o la urea) o con compuestos de alto peso molecular (como el medio de contraste radiográfico) brinde un resultado falsamente menor al de una medición por densitometría. Los colores varían de azul oscuro a lectura 1.005 hasta amarillo a lectura 1.030.[22]
- 1)En medio básico Polielectrolito-H + Cationesn+ → Polielectrolito-Cationes + nH+
- 1)En medio básico
- 2) En medio básico H+ + Azul de bromotimol(Azul) → Azul de bromotimol-H+(Amarillo)
- 2) En medio básico
Las concentraciones elevadas de proteína producen un aumento leve como consecuencia del error proteico del indicador, las muestras con pH mayor a 6,5 dan lecturas menores como consecuencia del viraje del indicador por lo que los fabricantes recomiendan agregar 5 a la lectura de densidad cuando el pH es mayor a 6,5.[22]
Analizador de orina
[editar]Existen analizadores de orina electrónicos para hacer múltiples análisis con las tiras reactivas, lográndose determinar calcio, sangre, glucosa, bilirrubina, urobilinógeno, cetonas, leucocitos, creatinina, microalbúmina, pH, ácido ascórbico, proteínas,[23]
Referencias
[editar]- ↑ «Copia archivada». Archivado desde el original el 26 de junio de 2015. Consultado el 9 de julio de 2011.
- ↑ http://vic-mesa72010.blogspot.com/2010/02/examen-general-de-orina.html
- ↑ «Copia archivada». Archivado desde el original el 16 de marzo de 2011. Consultado el 9 de julio de 2011.
- ↑ https://web.archive.org/web/20110828130553/http://www.fundaciondiabetes.org/diabetes/cont02.htm
- ↑ http://laboratorioclinico.110mb.com/cultivoorina.htm
- ↑ a b c Strasinger, Susan K.; Di Lorenzo Schaub, Marjorie (2008). «5». Análisis de orina y de los líquidos corporales (5ª edición). Editorial panamericana. pp. 56-57. ISBN 978-950-06-1938-7. Consultado el 13 de marzo de 2012.
- ↑ a b Centro de ventas de la ADW Diabetes.
- ↑ a b c d e f g h i j k l «Bayer Multistix reagent strips». Archivado desde el original el 18 de mayo de 2012. Consultado el 12 de marzo de 2012.
- ↑ a b c Strasinger, Susan K.; Di Lorenzo Schaub, Marjorie (2008). «5». Análisis de orina y de los líquidos corporales (5ª edición). Editorial panamericana. pp. 57-62. ISBN 978-950-06-1938-7. Consultado el 13 de marzo de 2012.
- ↑ a b Wein, Alan J.; Kavoussi, Louis R.; Novick, Andrew C.; Partin, Alan W.; Peters, Craig A. (2007). «3». Capmbell-Walsh Urología (9ª edición). Editorial Médica Panamericana. p. 100. ISBN 978-950-06-8268-8. Consultado el 13 de marzo de 2012.
- ↑ ENSAYOS PARA EL RECONOCIMIENTO DE ALDEHÍDOS Y CETONAS
- ↑ a b c d e Wein, Alan J.; Kavoussi, Louis R.; Novick, Andrew C.; Partin, Alan W.; Peters, Craig A. (2007). «3». Capmbell-Walsh Urología (9ª edición). Editorial Médica Panamericana. pp. 97-98. ISBN 978-950-06-8268-8. Consultado el 13 de marzo de 2012.
- ↑ a b c Wein, Alan J.; Kavoussi, Louis R.; Novick, Andrew C.; Partin, Alan W.; Peters, Craig A. (2007). «3». Capmbell-Walsh Urología (9ª edición). Editorial Médica Panamericana. p. 104. ISBN 978-950-06-8268-8. Consultado el 13 de marzo de 2012.
- ↑ a b c Strasinger, Susan K.; Di Lorenzo Schaub, Marjorie (2008). «5». Análisis de orina y de los líquidos corporales (5ª edición). Editorial panamericana. pp. 70-73. ISBN 978-950-06-1938-7. Consultado el 14 de marzo de 2012.
- ↑ Graff, Laurine (1987). «2». Análisis de orina - Atlas Color (1ª edición). Ed. Médica Panamericana. p. 59. ISBN 950-06-0841-3. Consultado el 14 de marzo de 2012.
- ↑ Graff, Laurine (1987). «2». Análisis de orina - Atlas Color (1ª edición). Ed. Médica Panamericana. p. 60. ISBN 950-06-0841-3. Consultado el 14 de marzo de 2012.
- ↑ a b c Wein, Alan J.; Kavoussi, Louis R.; Novick, Andrew C.; Partin, Alan W.; Peters, Craig A. (2007). «3». Capmbell-Walsh Urología (9ª edición). Editorial Médica Panamericana. p. 104. ISBN 978-950-06-8268-8. Consultado el 14 de marzo de 2012.
- ↑ a b c Strasinger, Susan K.; Di Lorenzo Schaub, Marjorie (2008). «5». Análisis de orina y de los líquidos corporales (5ª edición). Editorial panamericana. pp. 73-75. ISBN 978-950-06-1938-7. Consultado el 14 de marzo de 2012.
- ↑ a b c Strasinger, Susan K.; Di Lorenzo Schaub, Marjorie (2008). «5». Análisis de orina y de los líquidos corporales (5ª edición). Editorial panamericana. pp. 74-75. ISBN 978-950-06-1938-7. Consultado el 14 de marzo de 2012.
- ↑ Scheer, KA; Segert, LA; Grammers, GL (1984). «Urine leukocyte esterase and nitrite tests as an aid to predict urine culture results.». Lab Med 15 (3): 186-187.
- ↑ Strasinger, Susan K.; Di Lorenzo Schaub, Marjorie (2008). «4». Análisis de orina y de los líquidos corporales (5ª edición). Editorial panamericana. pp. 46-47. ISBN 978-950-06-1938-7. Consultado el 14 de marzo de 2012.
- ↑ a b c Strasinger, Susan K.; Di Lorenzo Schaub, Marjorie (2008). «5». Análisis de orina y de los líquidos corporales (5ª edición). Editorial panamericana. pp. 75-76. ISBN 978-950-06-1938-7. Consultado el 14 de marzo de 2012.
- ↑ «Copia archivada». Archivado desde el original el 30 de junio de 2012. Consultado el 9 de julio de 2011.
